元素周期表是学习和研究化学的重要工具,下表是元素周期表的一部分:
| ⅢA |
ⅣA |
ⅤA |
ⅥA |
5 硼 |
6 碳 |
7 氮 |
8 氧 |
| 13 Al 铝 |
14 硅 |
1 磷 |
16 硫 |
(1)请你写出15号元素的名称
(2)从原子结构看,氧和硫同属ⅥA(第六主族)的原因是
(3)上表中
(4)写出13号元素和16号元素的单质在高温下化合的化学方程式
在实验室里,小明与同学欲用下图所示装置(气密性良好)和药品制取初中化学常见气体并验证其有关性质。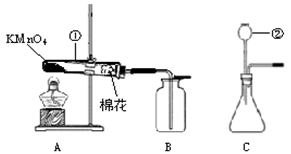
(1)写出图中标有序号的仪器名称:①,②。
(2)点燃A中的酒精灯制取并收集氧气,反应的化学方程式为。待检验到B中氧气已收集满,接下来的操作是,把集气瓶盖好玻璃片后,正放在桌面上。
(3)将点燃的蜡烛放入集满氧气的集气瓶中,可观察到且瓶壁上有水雾出现,证明蜡烛燃烧有水生成。接着,将蜡烛从集气瓶中取出,(填实验步骤和现象),证明蜡烛燃烧还生成了二氧化碳。
(4)小明同学发现装置C有一处明显错误:,将装置C改正后放入适量的药品:和,即开始制取气体(写一种)。
、
、
、
是初中化学常见的物质,在一定条件下四种物质存在如下图所示的转化关系:
。
(1)若
是硫酸,
是氢氧化钠,该反应的基本类型是反应。
(2)若
、
均是含同种元素的非金属氧化物,且
有毒性,
能被磁铁吸引。
①
的化学式是,其固体俗称;
②
的合金可用于制作炊具,主要是利用它的性。
(3)若
、
是都是金属单质,
、
都是盐,请写出一个符合要求的化学方程式:,该反应说明金属活动性:
(填"<"或">")
。
人们生活中的衣、食、住、行均与化学有着密切的联系。
(1)蛋白质是构成人体细胞的基础物质。下列食品中富含蛋白质的是(填标号)。
| A. | 鱼肉 | B. | 牛奶 | C. | 猪油 | D. | 蔬菜 |
(2)有一种面料叫"冰蚕丝"的衣服,其主要成分为合成纤维。用化学方法鉴别"冰蚕丝"和天然蚕丝:。
(3)甲醛(
)是一种(选填"有机物"或"无机物"),有剧毒且能致癌。用含有甲醛的材料装修房子,人进入后会闻到特殊气味,这主要与甲醛分子有密切关系,因此新装修的房子最好通风透气一段时间后才入住。
(4)无人驾驶汽车处理系统的核心材料是高纯度的硅。工业制硅的反应之一如下:
,该反应中,
的化学式是。
2015年5月12日,海西高速公路网的重要组成部分:福建省最长跨海大桥--泉州湾大桥正式通车。大桥的建设及通行涉及到许多的化学知识。
(1)制造大桥护栏和斜拉索等重要器件的材料都是钢,钢属于(选填"金属"或 "无机非金属")材料。
(2)工人给大桥钢铁器件喷上油漆,目的是为了防止铁与和发生反应而生锈。
(3)大桥施工过程中用乙炔(
)燃烧的火焰来焊接金属,乙炔在空气中完全燃烧生成二氧化碳和水,该反应的化学方程式为;乙炔燃烧时将能转化为热能和光能。
(4)大桥的建成,把隔海相望的泉州环湾城市群连成一片,驱车跨跃泉州湾只需8分钟,有利于节约化石燃料的使用,从而有利于减缓(填序号)。
①雾霾天气 ②温室效应 ③赤潮的形成 ④酸雨的形成
实验小组同学做了如下实验。
(1)
中反应的化学方程式为,将带火星的木条置于
处,若观察到,说明已有氧气产生。
(2)
中现象是声带涌出柱状的泡沫,可形象地称为"大象牙膏",其原理主要是
在某些催化剂作用下迅速分解产生水和氧气。反应的化学方程式为。