小刚学习了盐和化肥单元知识后知道,农家肥草木灰的主要成分是碳酸钾,决定利用自己掌握的知识探究碳酸钾溶液的酸碱性.
【溶液配制】将草木灰溶解、固液分离后得到澄清的碳酸钾溶液
【猜想与假设】碳酸钾溶液的酸碱度可能有种情况
【设计与实验】小刚进行了如下实验:
实验一:向盛有适量碳酸钾溶液的试管中滴加几滴紫色石蕊试液,溶液变为蓝色.
实验二:向盛有适量碳酸钾溶液的试管中滴加几滴无色酚酞试液,溶液变为红色.
实验三:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钾溶液滴在pH试纸上,测得pH=12.
【结论】以上实验证明碳酸钾溶液呈性,从物质的分类看,碳酸钾属于类(填"酸""碱""盐"),从而说明此类物质的水溶液不一定显中性.
【评价】以上三种实验方案中,实验三是从(填"定性"或"定量")角度对溶液进行研究.
下图是初中化学的几种常用仪器用品,根据要求回答下列问题: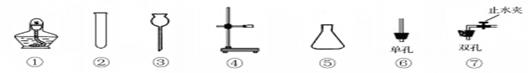
(1)仪器⑤的名称是。实验室用
固体加热制氧气应选用的仪器用品是(填序号)。
(2)③⑤⑦组合可制备 、 、 ,试写出用此装置制氧气的化学方程式为,实验前检查此装置气密性的方法是。
某学校化学课外活动小组,对铜制品生锈很很感兴趣.经查阅资料,知道铜锈的主要成份是碱式碳酸铜,俗称铜绿,化学式为
Cu2(OH)2CO3.他们在探究中发现,铜绿受热分解后,除生成二氧化碳和水蒸气外,试管中还有一些黑色粉末状固体.为了更清楚地了解这种黑色粉末,小明和小娜准备通过实验探究,进一步分析黑色固体的组成,并验证产生的气体:
(1)提出问题:黑色固体是什么?
(2)猜想与假设:
(3)设计实验方案:
向试管中的黑色固体滴加足量的 (填化学式)溶液,充分反应后,观察固体的溶解情况和所得溶液的颜色;
(4)现象与结论:
小刚和小娜经过实验之后,都给自己的猜想做了正确的评价.如果你的猜想是正确的话,实验现象应为: .
(5)若用如图所示装置验证两种气体生成物(无水硫酸 铜遇水变蓝),应将生成的混合气体先通过 B 装置,.当将气体通入装置A进行验证,气流应从 口通入.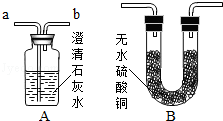
为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计出了下列4种实验装置,请回答下列问题:
(1)选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:
选择的实验装置是 .实验现象为: .
产生该实验现象的原因是: .
(2)某同学质疑上述实验设计,该同学质疑的依据是: .
(3)在原实验的基础上,请你设计实验证明CO2和NaOH肯定发生了化学反应. .
小芳和同学们一起研究酸、碱的化学性质.
【实验一】同学们将稀盐酸与刚配制好的氢氧化钠溶液混合,未观察到明显现象.
【实验二】小芳改进了实验,向氢氧化钠溶液中加入镁,没有现象,说明 .再逐滴加入稀盐酸(如图实验二).
(1)开始时没有气泡,持续滴加后产生气泡,说明盐酸确实和氢氧化钠发生了反应.
(2)请你帮他们再设计一个实验,(写出操作及现象)也能证明稀盐酸和氢氧化钠发生了反应:
.
(3)实验二给你提供的信息是: .
【实验三】小芳将稀盐酸加入到盛有氧化铁的试管中,发现溶液颜色逐渐变黄,证明发生了反应,反应化学方程式是为: .
【表达交流】有些反应伴随固体消失、变色等现象,有些反应没有明显的现象出现,可以通过 将无现象实验显性化,获得结论.
【反思应用】根据大家的交流,若继续向实验三反应结束后的溶液中,加入氢氧化钠溶液,发现刚开始没有沉淀,过一会儿有红褐色沉淀出现,说明 .
【拓展延伸】若将二氧化碳通入氢氧化钠溶液中,也无明显现象,请你设计一个实验 (实验操作及现象),说明两者发生了化学变化.
维生素C(简称Vc,又名抗坏血酸),易溶于水,易被氧化.人体缺乏Vc可能引发多种疾病.水果和蔬菜中含有丰富的Vc.某研究性学习小组对它探究如下:
探究一:检验三种饮品中Vc含量的顺序.
[查阅资料]Vc能和高锰酸钾反应,使紫色的高锰酸钾溶液褪色.
[设计方案]在三支试管中各盛2mL等浓度高锰酸钾稀溶液,分别逐滴滴加果味饮料、苹果汁和梨汁,边滴边振荡,直至高锰酸钾溶液褪色时,记下所用滴数.
[实验数据]
| 试管编号 |
A |
B |
C |
| 饮品 |
果味饮料 |
苹果汁 |
梨汁 |
| 滴加的滴数 |
40 |
10 |
20 |
[实验结论]分析数据可知,三种饮品中Vc含量由高到低的顺序是 .(填编号)
探究二:某同学联想到黄瓜等蔬菜中含有丰富的Vc,放置时间长短是否对Vc的含量产生影响,展开探究:蔬菜放置时间的长短对其Vc含量是否有影响.
[设计方案]请你用新鲜的黄瓜和放置一周的黄瓜、高锰酸钾稀溶液和必要的仪器设计实验方案: .
[实验结论]按上述方案实验,根据 这一实验结果,分析得出蔬菜放置时间的长短对其Vc的含量有影响.
[实验反思]化学实验需要控制变量,下列情况会影响到测定结果的是 .
A.试管的大小不同
B.没有用同一规格胶头滴管滴加
C.每次实验所用的黄瓜汁颜色不同
[思维拓展]某同学查找了Vc相关资料得知:Vc能溶于水,在加热或碱性环境中易被氧化而破坏,由此该同学继续以下探究:取2片Vc药片溶于水,滴入紫色石蕊溶液变红色,说明VC的溶液显酸性;加热该溶液至沸腾,红色溶液逐渐变成紫色,说明 ,那么在烹调新鲜蔬菜时要减少VC的损失,应采取的措施之一是: .