如图是某同学在厨房里看到的食用纯碱(主要成分是
)包装袋信息,他带了一包食用纯碱到学校实验室.
(1)为测定室温下
的溶解度,在编号为A、B、C、D的四个烧杯中各加入室温下的水100g,并分别加入取自实验室的
固体,搅拌至充分溶解,实验数据记录如表:
| 烧杯编号 |
A |
B |
C |
D |
| 水的质量/克 |
100 |
100 |
100 |
100 |
| 加入
的质量/克 |
30 |
35 |
40 |
50 |
| 溶液的质量/克 |
130 |
135 |
140 |
140 |
分析上述数据,烧杯编号为CD中的溶液是饱和溶液,室温下,
的溶解度是
(2)为确定食用纯碱的纯度,称取自带的食用纯碱5.4g放入烧杯中,再滴加盐酸至刚好完全反应,共用去稀盐酸25g,得溶质质量为28.2g(杂质溶于水且与盐酸不反应),通过计算判断该食用纯碱中碳酸钠的质量分数是否与包装袋信息相符.(计算结果精确到0.1%)
过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验。测得相关数据如图9所示:
(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程)友情提示:实验中过氧化氢分解的化学方程式为 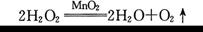
、实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
 |
1 |
2 |
3 |
4 |
| 加入氢氧化钠溶液的质量/g |
25 |
25 |
25 |
25 |
| 生成沉淀的质量/g |
2.9 |
X |
8.7 |
8.7 |
(1)上表中X的数值为_________;
(2)计算原固体混合物样品中氯化镁的质量分数是多少?
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
、某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰
石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质
既不和酸反应,也不溶于水),过滤、洗涤、干燥后称量滤渣质量的数据如下表:
| 实验序号 |
样品的质量/g |
滤渣的质量/g |
| 第一次 |
3.4 |
0.3 |
| 第二次 |
3.6 |
0.4 |
| 第三次 |
5.0 |
0.5 |
(1)该样品中碳酸钙质量分数的平均值为:▲(结果精确到0.1%)。
(2)引起三次实验数据差异的操作原因可能是:▲。
(3)若利用题(1)的结果,煅烧100t这种石灰石,理论上最多能得到氧化钙多少吨?(结果精确到0.1t)
、钛合金是21世纪的重要材料。工业上制取金属钛(Ti)的一个反应的化学方程式为:TiCl4 + 2Mg  Ti + 2MgCl2。制取金属钛12t,可同时生成副产品氯化镁多少吨?
Ti + 2MgCl2。制取金属钛12t,可同时生成副产品氯化镁多少吨?
(10咸宁34).现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:
(1)生成氧气的质量。
(2)瓶内过氧化氢溶液中溶质的质量分数。