为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq)  FeSO3(s)
FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色。
某同学设计如下实验,正式该假设的成立:
溶液E和F分别是___________、_______________
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因___________________________
学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)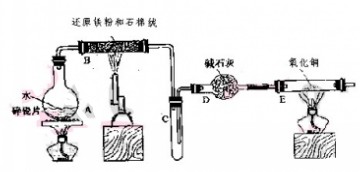
(1) 回答下列问题:所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为__ __(填序号)。
| A.稀盐酸 | B.氢氧化钠溶液 | C.浓硫酸 | D.FeCl3溶液 |
经除杂后的铁粉进一步干燥后装入反应容器。
(2)反应发生后装置B中发生反应的化学方程式是___________________。
D装置的作用:_______________________.
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下: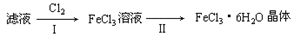
①步骤I中通入Cl2的作用
(填:氧化剂,还原剂,氧化产物,还原产物)
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。
向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理(填”合理”或”不合理”)。
实验室用下图装置制取少量溴苯,试填写下列空白。
(1)在烧瓶a中装的试剂是、、。
(2)请你推测长直导管b的作用:一是,二是 的作用。
(3)请你分析导管c的下口可否浸没于液面中?为什么?
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有褐色不溶于水的液体,这可能是因为 的缘故。简述获得纯净的溴苯应进行的实验步骤:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。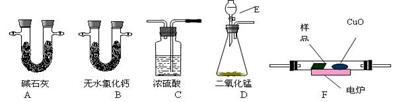
 (1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是
(1)现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:(1)按上述所给的测量信息,装置的连接顺序应是 ;
;
(2)A、B管内均盛有有固态试剂,A管的作用是_________;
(3)E中应盛装什么试剂:_________;
(4)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(5)请改进这套装置的一个不足之处;(6)该有机物的实验式为_____________;
(7)要确定该有机物的分子式,还必须知道的数据是___________。(填编号)
①消耗液体E的质量②样品的摩尔质量③ CuO固体减少的质量④ C装置增加的质量
⑤燃烧消耗O2的物质的量
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。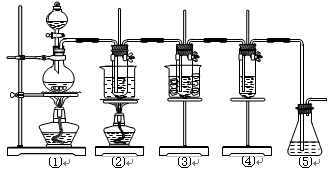
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。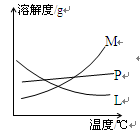
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
_______________________________ |
| 然后溶液从无色逐渐变为_______色 |
_______________________________ |
(共14分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)D的化学式是,判断理由是。
(2)写出其余几种物质的化学式:A,B,C。
(3)写出实验②中有关反应的离子方程式
。