共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: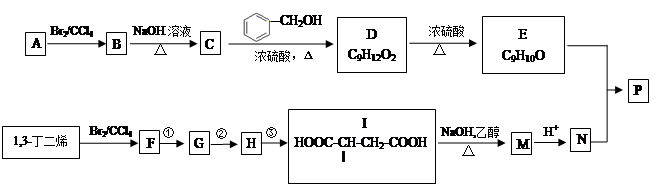
(1)A的结构简式为________________
(2)C的名称为
(3)I由F经①~③合成,F可以使溴水褪色.
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(4)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(5)高聚物P的亲水性,比由E形成的聚合物__________(填“强、弱”).
(6)E与N按照物质的量之比为1:1发生共聚生成P,P的结构简式为
(7)E有多重同分异构体,符合下列条件的异构体由 种(不考虑顺反异构),写出其中的一种
a.分子中只含一种环状结构
b.苯环上有两个取代基
c.1mol该有机物与溴水反应时能消耗4molBr2
亚硝酸钠( NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+
NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+ Fe3+
Fe3+
(1)转化1中,氧化剂是,还原剂是。
(2)转化2中,Fe3+作剂,维生素C表现性。
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
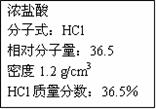  |
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)配制250mL 0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL |
应选用容量瓶的规格/mL |
A.用量筒量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀。
B.将已冷却的盐酸沿玻璃棒注入容量瓶中。
C.用蒸馏水洗涤2—3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm 处,改用加水,使溶液凹面恰好与刻度相切。
处,改用加水,使溶液凹面恰好与刻度相切。
E.将容量瓶盖紧,振荡,摇 匀。
匀。
(3) 若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度;
③定容时俯视容量瓶刻度线。
(4)实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O 此反应不需要加热,常温下就可以迅速进行。
①用“双线桥法” 标明电 子转移的方向和数目:
子转移的方向和数目:
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为mol,需要KMnO4的质量 g
将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断: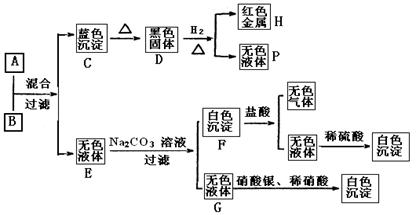
(1)A的化学式B的化学式。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D→H+P:
(3) 写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)盐溶液B中阴离子的检验方法是
工业上对海水资源综合开发利用的部分工艺流程如下图所示。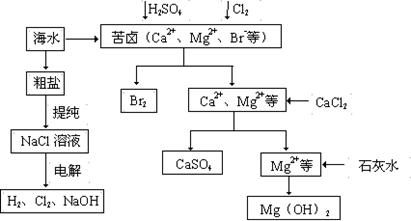
⑴ 粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出加入Na2CO3溶液后相关化学反应的离子方程式:
、。
⑵ 从海水中提取溴,主要反应为2Br- + Cl2 = Br2 + 2Cl-,下列说法错误的是(填序号)。
| A.溴离子具有氧化性 | B.氯气是还原剂 |
| C.该反应属于复分解反应 | D.Br2是氧化产物 |
⑶ 本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
(填“能”或“否”),原因是。
(12分)(1)5molCO2的质量是_________;在标准状况下所占的体积约为_________;所含的分子数目约为________________;所含氧原子的数目约为_________________。
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是________,X的相对原子质量是________,该物质的化学式为________。
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3、H2O组成一个氧 化还原反应,请回答下列问题:
化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对 应的横线上,组成一个未配平的化学方程式:
应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→ Na2SO4+________+________+H2O
②反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。