常温下,在l00mL 1mol/L 的NaHCO3溶液中,加入Xmol的Ba(OH)2固体(假设溶液体积和温度保持不变)。以下关于溶液中c(CO32-)及c(HCO3-)的变化判断正确的是
| A.当X=0.025时,溶液中有HCO3-和CO32-,且2C (CO32-) =" C(" HCO3-) |
| B.当X=0.05时,溶液中有HCO3-和CO32-,且C (CO32-)> C( HCO3-) |
| C.当X=0.06时,溶液中HCO3-、CO32-浓度都减小了 |
| D.当X=0.1时,溶液pH增大,沉淀达到最大值 |
化学反应A2(g)+B2(g)= 2AB(g)的能量变化如图所示,下列有关叙述中正确的是( )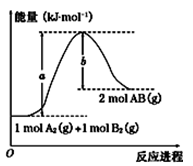
| A.每生成2 mol AB(g)共吸收b kJ能量 |
| B.该反应热ΔH=+(a-b)KJ·mol-1 |
| C.反应物的总能量大于生成物的总能量 |
| D.断裂1 mol A—A键,放出a kJ能量 |
2L密闭容器中,反应2SO2(g)+O2(g) 2SO3(g),经一段时间后SO3的物质的量增加了0.8 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·min -1,则这段时间为( )
2SO3(g),经一段时间后SO3的物质的量增加了0.8 mol ,在这段时间内用O2表示的反应速率为0.4 mol·L-1·min -1,则这段时间为( )
| A.0.5s | B.1s | C.30s | D.60s |
在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是()
A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s)
C、v(C)=0.8mol/(L·s) D、v(D)=1.0mol/(L·s)
在一定条件下,向体积为2L的密闭容器中加入2 mol N2和10 mol H2发生如下反应:
N2+3H2 2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是()
2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是()
| A.v(N2)=0.25mol·L-1·min-1 | B.v(H2)="0.0125" mol·L-1·s-1 |
| C.v(NH3)="1.0" mol·L-1·min-1 | D.v(H2)="0.75" mol·L-1·min-1 |
恒温恒压下,对于反应X2(g)+ Y2(g)  2XY(g)达到平衡状态的标志是 ()
2XY(g)达到平衡状态的标志是 ()
| A.V正(X2)=2V逆(XY) |
| B.单位时间内生成2n mol XY的同时,生n mol的Y2 |
| C.容器内气体密度不随时间而变化 |
| D.X2、Y、XY的浓度之比为2:2:1 |