微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、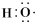 |
C. 、 、 |
D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag.。下列结论错误的是
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ | B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+的物质的量比为1∶2 | D.1 mol Fe可还原2 mol Fe3+ |
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O;已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀 ;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
| A.直接加碱,调整溶液pH≥9.6 | B.加纯铜粉,将Fe2+还 原出来 原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 | D.通入硫化氢,使Fe2+直接沉淀 |
为了检验某含有 杂质的
杂质的 样品的纯度,现将
样品的纯度,现将 克样品加热,其质量变为
克样品加热,其质量变为 则该样品的纯度(质量分数)是
则该样品的纯度(质量分数)是
除去下列物质中的杂质(括号内为 杂质),所选用的试剂及操作方法均正确的一组是
杂质),所选用的试剂及操作方法均正确的一组是
| 选项 |
待提纯的物质 |
选用的试剂 |
操作的方法 |
| A |
CaO(CaCO3) |
水 |
溶解、过滤、结晶 |
| B |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
| C |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
| D |
CO(H2) |
氧气 |
点燃 |
下列实验操作中错误的是
| A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,且冷凝水方向应当由下往上 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶 |