碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为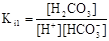 |
B.Ki2对应的电离过程是HCO3— + H2O 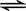 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O==4Al(OH)3,下列说法不正确的是()
| A.正极反应式为:O2+2H2O+4eˉ==4OHˉ |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 | D.产生气泡的速度甲比乙慢 |
在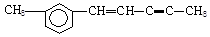 分子中,处于同一平面上的原子数最多可能有:()
分子中,处于同一平面上的原子数最多可能有:()
| A.12个 | B.14个 | C.18个 | D.20个 |
下列五种烷烃:①2—甲基丁烷②2,2一二甲基丙烷③戊烷④丙烷⑤丁烷,它们的沸点由高到低的顺序排列正确的是()
| A.①②③④⑤ | B.②③⑤④① | C.④⑤②①③ | D.③①②⑤④ |
足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的总量,可向盐酸中加入适量的物质是()
| A.NaOH固体 | B.CH3COONa固体 | C.NaCl晶体 | D.Na2CO3固体 |