下列化学表述正确的是
A.氯化钠的晶体模型: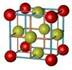 |
B.铍原子最外层的电子云图: |
| C.次氯酸的结构式:H-O-Cl |
| D.CH3CHOHCH(CH3)2名称:2-3-二甲基丙醇 |
下列物质性质的变化规律中与共价键键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高;②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅;④NaF、NaCl、NaBr、NaI熔点依次降低
| A.仅③ | B.①③ | C.②④ | D.②③ |
长式周期表共有18个纵行,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是
| A.第9列元素中有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
向FeCl3和BaCl2的混合液中通入过量SO2,有白色沉淀产生。下列说法正确的是
| A.白色沉淀为BaSO3 | B.该实验表明FeCl3有还原性 |
| C.反应后溶液酸性增强 | D.反应后滴加KSCN溶液显红色 |
下列有关物质结构和性质的叙述正确的是:
①具有16个质子、16个中子和18个电子的微粒符号可表示为:32 16S2-;
②羟基电子式为: ;
;
③HClO的结构式:H—Cl—O;
④NaHCO3在水中的电离方程式:NaHCO3→Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化
| A.①②⑤ | B.①④⑥⑦ | C.②③④⑥ | D.②③⑤⑥⑦ |
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是()
| 纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
| A |
胆矾 |
水煤气 |
硫酸 |
醋酸 |
干冰 |
| B |
氢氧化钡 |
蔗糖溶液 |
硫酸钡 |
醋酸 |
氢气 |
| C |
碱石灰 |
石灰水 |
苛性钾 |
水 |
氨气 |
| D |
石灰石 |
水玻璃 |
氯化钙 |
氢氧化铁 |
碳酸钙 |