有关下图电化学装置的叙述中,正确的是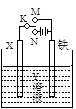
| A.若X为碳棒,Y为饱和食盐水,K置于N,则铁极上析出氯气 |
| B.若X为铂棒,Y为CuCl2溶液,K置于N,则铁棒质量将增加 |
| C.若X为锌棒,Y为海水,K置于M,形成对铁的外加电流阴极保护 |
| D.若X为铜棒,Y为稀硫酸,K置于M,则正极反应为:Fe−2e→Fe2+ |
下列说法正确的是()
A.油脂属于酯类,均不能使溴水褪色
B.葡萄糖、蔗糖、纤维素均能发生水解反应
C.某有机物完全燃烧后生成CO2和H2O,说明该有机物中必定含有C、 H 、O三种元素
D.工业上常用电解法冶炼镁单质
下列说法中正确的是()
| A.H2和D2互为同位素 | B. 互为同分异构体; 互为同分异构体; |
| C.乙烷和丁烷互为同系物 | D.淀粉和纤维素互为同分异构体 |
右图为铜锌原电池示意图,下列说法中正确的是()
| A.锌片逐渐溶解 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.电子由铜片通过导线流向锌片 |
| D.该装置能够将电能转化为化学能 |
若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则( )
| A.x=2,y=2 | B.x=2,y=4 | C.x=3,y=6 | D.x=3,y=8 |
下列叙述正确的是()
| A.共价化合物中一定没有离子键 | B.阴、阳离子通过静电引力所形成的化学键叫离子键 |
| C.离子化合物中一定没有共价键 | D.非金属元素之间构成的化合物肯定不是离子化合物 |