常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| |
一氧化氮 |
硝酸 |
转移的电子 |
| A. |
1mol |
|
2NA |
| B. |
11.2L |
1mol |
|
| C. |
|
63g |
2mol |
| D. |
|
1mol |
NA |
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。
C(g)+3D(g) ΔH<0。
该可逆反应的反应速率-时间、转化率-时间关系图如下: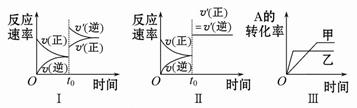
下列分析中不正确的是
| A.图Ⅰ可体现t0时升高温度对反应速率的影响 |
| B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)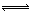 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
| A.该反应的化学平衡常数表达式是K= [ C ]4 [ D ]2 / [ A ]3 [ B ]2 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
下列反应中符合下图图像的是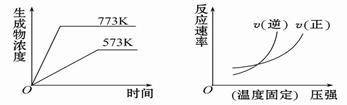
A.N2(g) + 3H2(g)  2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) 2NH3(g) ΔH =-Q1 kJ·mol-1 (Q1>0) |
B.2SO3(g)  2SO2(g) + O2(g) ΔH =" +" Q2 kJ·mol-1 (Q2>0) 2SO2(g) + O2(g) ΔH =" +" Q2 kJ·mol-1 (Q2>0) |
C.4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0) 4NO(g) + 6H2O(g) ΔH =-Q3 kJ·mol-1 (Q3>0) |
D.H2(g) + CO(g)  C(s) + H2O(g) ΔH =" +" Q4 kJ·mol-1 (Q4>0) C(s) + H2O(g) ΔH =" +" Q4 kJ·mol-1 (Q4>0) |
已知下列反应的热化学方程式:
① C(金刚石,s) + O2(g) === CO2(g) ΔH1
② C(石墨,s) + O2(g) === CO2(g) ΔH2
③ C(石墨,s) === C(金刚石,s) ΔH3=1.9 kJ/mol
则下列说法正确的是
| A.石墨转化成金刚石的反应是吸热反应 |
| B.金刚石比石墨稳定 |
| C.ΔH3=ΔH1-ΔH2 |
| D.ΔH1>ΔH2 |
下列情况下,反应速率相同的是
| A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |