2007年8月《地球学报》杂志报道,利用氮、氧及氮、硼同位素技术,通过测定可知地下硝酸盐来源的水污染情况。完成下列填空:
(1)关于14N与15N的正确说法是 ;
a、自然界氮元素中14N的含量:空气中大于地壳中 b、单质:14N2与15N2互为同位素
c、电子层结构:14N与15N完全相同 d、原子半径:14N小于15N
与N元素同周期且最外层有2个未成对电子的元素相互组成的化合物属于 分子。(填:“极性”、“非极性”、“极性或非极性”)
(2)NH3与H2O分别能与H+ 结合成NH4+与H3O+。与NH4+具有相同空间构型的微粒是 ;
a、H3O+ b、CH4 c、P4 d、NH3
分子中的键角:CH4 P4(填:“>”、“=”或“< ”)。
(3)H3O+ 与NH4+ 的水溶液均显酸性。用离子方程式表示NH4+ 水溶液显酸性的原因:
。
(4)使用N、O、 B同位素,并结合水化学分析,将更有利于对测定结果的解释。写出B原子的最外层电子排布式 ;B原子核外的电子处在 个不同的能级上。
下列反应的离子方程式书写正确的是()
| A.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑ |
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 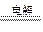 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O |
| D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
下列离子方程式书写正确的是()
| A.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO |
B.NH4HSO3溶液与足量的NaOH溶液混合后加热:NH4+ +HSO3- +2OH-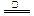 NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3- +5I-+3H2O=3I2+6OH- |
| D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42- = CaSO4↓+H2O |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.二硫化碳的分子模型为 |
B.向碳酸氢镁溶液中加入过量氢氧化钠:Mg2++HCO- 3+OH- MgCO3↓+H2O MgCO3↓+H2O |
C.硫氢化钠的水解:HS-+H2O H3O++S2- H3O++S2- |
D.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g) 2H2O(g);ΔH=-571kJ/mol 2H2O(g);ΔH=-571kJ/mol |
已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
复分解反应存在一个规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列离子反应不能成立的是()
| A.CO32-+C6H5OH→HCO3-+C6H5O- | ||
| B.CO2+H2O+ClO-=HCO3-+HClO 20090318 |
C.CO2+H2O+ C6H5O-→HCO3- +C6H5OH |
D.CO2+H2O+ 2C6H5O-→ CO32-+2C6H5OH |
相同温度、相同物质的量浓度的四种溶液:
①CH3COONa,②NaHSO4,③NaCl,④ ,按pH由大到小排列正确的是
,按pH由大到小排列正确的是
()
| A.④>①>③>② | B.①>④>③>② |
| C.①>②>③>④ | D.④>③>①>② |