某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
(2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目: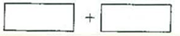
(4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH- AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
下图涉及的物质均为中学化学中的常见物质,C、D、E、F为单质(其中有两种为常见金属),其余为化合物或溶液。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出化学式:A;E。
(2)指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。
(3)反应③的化学方程式为。
(4)G还可与B、NaNO3的稀溶液混合反应生成H,请写出此反应的离子方程式。
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B—少一个电子层,B原子得一个电子填入3p轨道后, 3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2—离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体属于密置堆积方式,则其晶体晶胞类型属于 。(填写“六方”、“面心立方”或“体心立方”)。
(2)B—的电子排布式 ,在CB3分子中C元素原子的原子轨道发生的是_______杂化。
(3)C的氢化物空间构型为 ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是 。
(4)B元素的电负性 D元素的电负性(填“>”,“<”或“=”);用一个化学方程
式说明B、D两元素形成的单质的氧化性强弱: 。
(5)如上图所示是R形成的晶体的晶胞,设晶胞的边
长为acm。则R晶体的密度为 。(阿伏加德数常数用NA表示)
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知: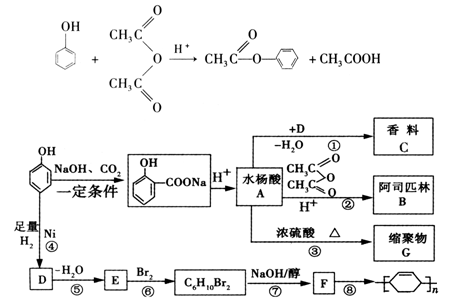
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④,⑦。
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: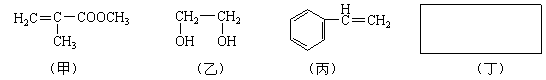
填写下列空白:
(1)甲中不含氧原子的官能团是。
(2)甲的同分异构体有多种,写出其中一种不含甲基的链状羧酸的结构简式。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):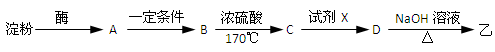
A的分子式是,试剂X可以是。
(4)利用以下信息,以苯、乙烯、氯化氢为原料经三步反应合成丙:(—R为烃基)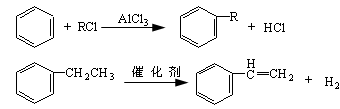
其中属于取代反应的化学方程式是。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁的核磁共振氢谱图像仅有2个波峰,强度比为2:1。则丁的结构简式为。
根据图示回答下列问题: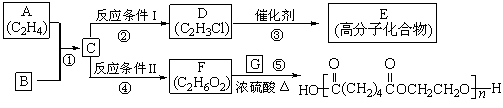
(1)写出A、E、G的结构简式:A____________,E___________,G___________;
(2)反应②的化学方程式(包括反应条件)是:_______________________
反应④化学方程式(包括反应条件)是:__________________________________;
(3)写出①、⑤的反应类型:①________________、⑤______________。