某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:______________________________________________。
(2)实验②的化学反应中转移电子的物质的量是________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是________
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,实验小组利用A制备Al(OH)3的操作流程如下: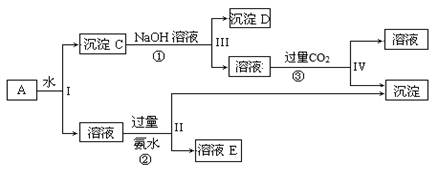
据此回答下列问题:
(1)I、II、III、IV四步中分离溶液和沉淀所采取的操作名称是,该实验操作所用到的玻璃仪器有。
(2)根据上述流程,写出D、E所含物质的化学式:
沉淀D;溶液E、。
(3)写出②、③反应的离子方程式:
②;③;
在100 mL MgCl2和AlCl3的混和溶液中,逐滴加入1 mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,
则:
(1)图中C点表示加入mLNaOH,AB段发生的离子反应方程式。
(2)c(MgCl2)=mol·L—1
(3)图中线段OA︰AB=。
某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原理是:。
(2)操作Ⅰ的目的是:,该反应的离子方程式是:。
(3)写出加入(NH4)2CO3所发生反应的离子方程式:,
滤液A的一种用途是。
有下列转化关系(反应条件略):
已知:① X、Y、Z、W均为氧化物。常态下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。② 相对分子质量:甲﹤乙。③ 将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请填写下列空白:
(1)Z的化学式:。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,反映出乙的浓溶液具有性。利用这种性质可以进行项(填字母)实验操作。
a.钝化铁片b.检验Ba2+离子c.干燥氨气 d.干燥氯气
(3)在X和Z的反应中,被氧化的X与被还原的X的物质的量之比是:。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2 ,写出该反应的化学方式:。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:。
某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。






(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是_______,有关的离子反应式为_______。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_____。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |