在100 mL MgCl2和AlCl3的混和溶液中,逐滴加入1 mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如下图所示,
则:
(1)图中C点表示加入 mLNaOH,AB段发生的离子反应方程式 。
(2)c(MgCl2)= mol·L—1
(3)图中线段OA︰AB= 。
二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能。
Ⅰ.工业制备二甲醚的生产流程如下: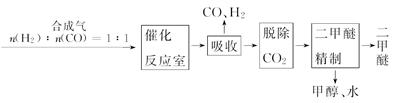
催化反应室中(压强2.0~10.0 MPa,温度230~280℃)进行下列反应:
CO(g)+2H2(g) 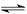 CH3OH(g)ΔH=-90.7 kJ/mol ①
CH3OH(g)ΔH=-90.7 kJ/mol ①
2CH3OH(g) 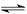 CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ/mol ②
CO(g)+H2O(g) 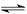 CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
CO2(g)+H2(g)ΔH=-41.2 kJ/mol ③
(1)甲烷氧化可制得合成气,反应如下:CH4(g)+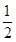 O2(g)
O2(g)  CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是反应(填“自发”或“非自发”)。
CO(g)+2H2(g) ΔH=-35.6 kJ/mol。该反应是反应(填“自发”或“非自发”)。
(2)催化反应室中总反应3CO(g)+3H2(g) 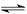 CH3OCH3(g)+CO2(g)的ΔH=。830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的ΔH=。830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”)。
(3)上述反应中,可以循环使用的物质有。
Ⅱ.如图为绿色电源“二甲醚燃料电池”的工作原理示意图。b电极是极。
反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:
(1)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
(2)由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
(3)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2T3(填“>”、“<”、“=”),判断的理由是。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的棒,乙装置中的棒。
②乙装置中阳极的电极反应式是:。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:。
②甲装置中碳极的电极反应式是,乙装置碳极的电极反应属于(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:。
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)。
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=。
(2)HA的电离平衡常数K=;
(3)升高温度时,K(填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的倍。