(12分).
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为_______________。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为_______。平衡时A 的转化率为_____.
(3) ①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总=_______mol,n(A)=_______mol。
②下表为反应物A浓度与反应时间的数据,计算a= _______________
| 反应时间t/h |
0 |
4 |
8 |
16 |
| C(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是_________________,由此规律推出反应在12h时反应物的浓度c(A)为_______mol·L-1
有机物F是新型降压药替米沙坦的中间体,其结构如下图。
(1)有机物F的分子式为。
(2)下列关于有机物F的叙述,不正确的是。(填标号)
| A.能发生水解反应 |
| B.能使酸性高锰酸钾溶液褪色 |
| C.苯环上的一氯取代产物有3种 |
| D.不能发生加成反应 |
(3)有机物F可由下列路线合成: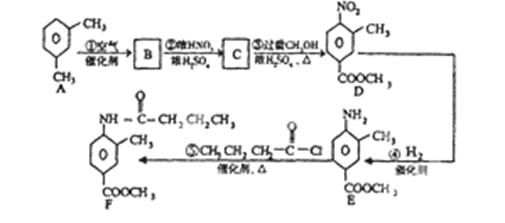
①B的结构简式为。
②反应①—⑤中,属于取代反应的是。(填序号)
③C→D的化学方程式是。
④满足下列条件的B的同分异构体共有种,其中苯环上的核磁共振氢谱有3种峰的结构简式为。
i.含有苯环,能发生水解反应 ii.能与新制Cu(OH)2悬浊液反应
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)基态铬原子的价电子排布式为。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:K2Cr2O2+3CCl42KC+2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是(用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于晶体。
③COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiOFeO(填”<”、 “=”或 “>”)。
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O],其结构如图。下列说法不正确的是(填标号)。
| A.该复合物中存在化学健类型只有离子键、配位键 |
| B.该复合物中Cl原子的杂化类型为sp3 |
| C.该复合物中只有CO和H2O作为配位体 |
| D.CO与N2的价电子总数相同,其结构为C=O |
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是。
元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。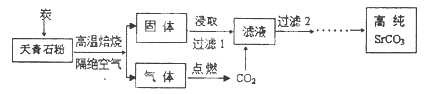
(1)写出与元素锶同族第3周期元素的原子结构示意图:。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式:。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是(用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为: SrSO4(s)+CO
SrSO4(s)+CO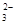 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO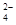 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K=。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是(写一种)。
(1)医疗上常用浓度为75%的某有机物水溶液作皮肤消毒液。该有机物的结构简式是。
(2)一定条件下,0.1mol氨气与氧气反应生成两种无毒气体,放出31.67kJ热量。写出核反应的热化学方程式:。
(3)现有固体X,可能含有Cu、SiO2、KNO3、NH4Cl中的一种或几种。为了探究其成分,某学习小组取该样品进行如下实验(部分产物已略去)。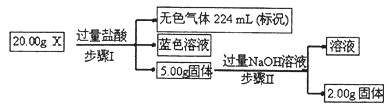
①步骤I中发生反应的离子方程式为。
②20.00gX中Cu的质量分数为。
③为进一步确定固体X的组成,常温下,学习小组另取固体X加水,充分搅拌后过滤,测得滤液的pH<7。他们判断一定有NH4Cl,理由是。
(4)工业上常用电渗析法生产HI,其模拟实验如图。写出阴极的电极反应式:。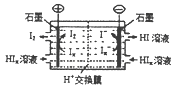
异丁酸苯乙醋、苯甲酸苯乙醋是常见的香料,烃A通过下列转化可得到上述有机物(已知A的相对分子质量为104,完全燃烧时生成CO2和H2O的物质的量之比为2∶1)。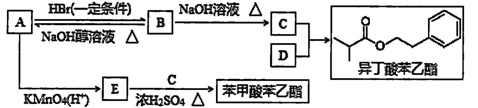
回答下列问题:
(1)A的结构简式为。
(2)B→A的反应类型是。
(3)D与C反应生成异丁酸苯乙酯的化学方程式为。
(4)下列关于异丁酸苯乙酯和苯甲酸苯乙酯的说法中,不正确的是。
a.一定条件下能发生水解反应
b.一定条件下能发生加成反应
c.等物质的量的两种有机物完全燃烧消耗等质量的O2
(5)F是苯甲酸苯乙酯的同分异构体,F属于酯类且F的二个苯环上都只有一个支链,F的结构简式为(写出其中的任意一种)。
(6)一定条件下,由苯甲酸甲酯与苯乙醇反应也能生成苯甲酸苯乙酯。写出该反应的化学方程式:。