氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)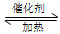 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。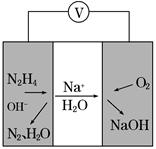
③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
(1)现有同温同压下的0.3mol SO2和0.2mol CO2 ,两者的质量比为;所含原子个数比为;密度比为;
(2)有一金属氯化物MCl227g , 含有0.40molCl-, 则该氯化物的物质的量为, 其摩尔质量为,金属M的相对原子质量为。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过下图所示装置研究反应速率的有关问题。取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。

请在上图的方框中画出上述反应的速率(mL/min)与时间(min,)的定性关系曲线。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:________
(1)在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是________;不能用铜丝搅拌棒代替的原因是________;实验中需要用到量筒的个数为________;反应的终止温度为________。
(2)写出NaOH稀溶液与稀硫酸反应的热化学方程式___________
在一定条件下,有反应xA+yB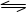 zC。
zC。
Ⅰ、若A、B、C均为气体,在2 L的密闭容器中,加入2 mol A、1 mol B,一定温度下达到平衡。测得平衡后的压强为反应前的 ,平衡时C为0.6 mol·L-1,B为0.2 mol·L-1。
,平衡时C为0.6 mol·L-1,B为0.2 mol·L-1。
试回答下列问题:
(1)平衡时B的物质的量是,B的转化率=
(2)x∶y∶z=,该温度下平衡常数=
Ⅱ、若反应xA+yB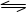 zC已达到平衡。改变条件后,其速率与时间的变化如图甲和乙。试回答下列问题:
zC已达到平衡。改变条件后,其速率与时间的变化如图甲和乙。试回答下列问题:
(1)图甲中t1时改变的条件可能是(填字母序号)。
A.若A、B均为固体,加入A或B
B.若A或B为气体,C为固体,增大压强
C.A、B中至少有一种是气体,且加入该气体
D.升高温度
E.加入催化剂
(2)若A、B、C均为气体,加入x mol A、y mol B,达到平衡后发生如图乙中t2时的变化。则此时发生变化的条件为(写出一种情况即可):
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)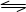 CO2(g)+H2(g);△H<0试回答下列问题:
CO2(g)+H2(g);△H<0试回答下列问题:
①若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=.
②在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。