(1)现有同温同压下的0.3mol SO2和0.2mol CO2 ,两者的质量比为 ;所含原子个数比为 ;密度比为 ;
(2)有一金属氯化物MCl2 27g , 含有0.40molCl-, 则该氯化物的物质的量为 , 其摩尔质量为 ,金属M的相对原子质量为 。
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为,C的元素名称为 。
(3)D的单质与水反应的方程式为_。
(4)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是,有关反应的离子方程式为;。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)已知 2CH3CHO+O2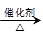 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示: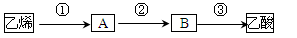
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________,反应类型是__________________。
A、B、C、D是原子序数依次增大的同一短同期元素,A、B是金属元素,C、D是非金属元素。
(1)A、B各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____________________。
(2)A与C 可形成化合物A2C,该化合物的电子式为______________。
(3)C的低价氧化物通入D单质的水溶液中,发生反应的化学方程式为_______________。
(4)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示):
_____>_____>______>______。
(5)四种元素中金属性最强的(填元素符号)______;非金属性最强的__________
下列各物质中,互为同位素的是________,互为同素异形体的是________,互为同系物的是________,互为同分异构体的是__________,属于同一种物质的是________。
①金刚石与石墨
②12C与14C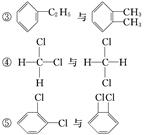
向20 mL AlCl3溶液中滴入2 mol/L NaOH溶液时,得到沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义是。
(2)图中B点表示的意义是。
(3)若溶液中有Al(OH)3沉淀0.39 g,则用去NaOH溶液的
体积可能为或毫升。