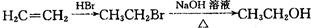二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响
________________________________________________________________________。
(3)有研究者在催化剂(含CuZnAlO和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是_________________________________________________。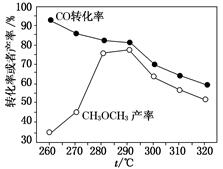
(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________
_____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
(12分)[物质结构与性质]
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域。下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程。
(1)Ti基态的电子排布式为。
(2)TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃。
固态TiCl4属于晶体。
(3)BaCO3为离子化合物。CO32-中C原子的杂化类型为,写出一种与CO32-互为等电子体的阴离子:
(填化学式)。
(4)钛酸钡的晶胞如图所示,其化学式为。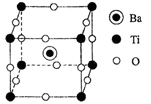
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2•H2O。1mol该配合物中含有σ键的数目为。
(14分)质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:①C(s)+1/2O2(g)="CO(g)" △H1=-110.35kJ/mol;
②2H2O(l)=2H2(g)+ O2(g)△H2=+571.6kJ/mol
③H2O(l)=H2O(g)△H3=+44.0kJ/mol
则:C(s)+H2O(g)=CO(g)+H2(g)△H4=。
(2)燃料气(流速为1800mL•h-1;体积分数为:50%H2,0.98%CO,1.64%O2,47.38%N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为。
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图所示。
加入(填酸的化学式)的CuO/CeO2催化剂催化性能最好。催化剂为CuO/CeO2-HIO3,120℃时,反应1小时后CO的体积为mL。
(3)下图为甲酸质子交换膜燃料电池的结构示意图。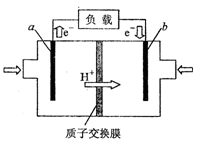
该装置中(填“a”或“b”)为电池的负极,负极的电极反应式为。
(15分)草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4•7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下: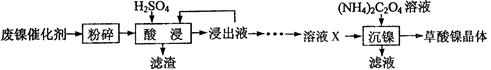
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0 mol•L-1计算):
②Ksp(CaF2)= 1.46×10-10 Ksp(CaC2O4)= 2.34×10-9
(1)粉碎的目的是。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图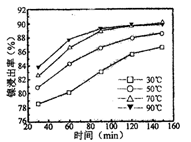
“酸浸”的适宜温度与时间分别为(填字母)。
| A.30℃、30min | B.90℃、150min |
| C.70℃、120min | D.90℃、120min |
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干,得草酸晶体。
①用乙醇洗涤的目的是;
②烘干温度不超过110℃的原因是。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)
②第2步中加入适量NH4F溶液的作用是。
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol•L-1Na2C2O4溶液(过量)和25mL6mol•L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol•L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol•L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为[已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将(填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(15分)葛根大豆苷元(F)用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下: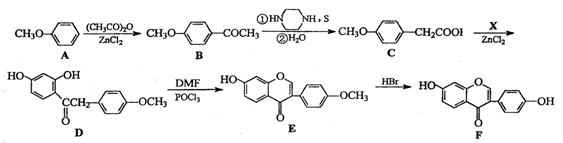
(1)化合物C中的含氧官能团有 、 (填官能团名称)
(2)已知:C→D为取代反应,其另一产物为H2O,写出X的结构简式:
(3)反应E→F的反应类型是
(4)写出同时满足下列条件的B的两种同分异构体的的结构简式: 。
Ⅰ.属于芳香族化合物,分子中有4种不同化学环境的氢;
Ⅱ.能与FeCl3溶液发生显色反应;
Ⅲ.不能发生水解反应,能发生银镜反应。
(5)根据已有知识并结合相关信息,写出以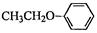 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体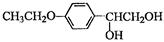 的合成路线流程图(无机试剂任
的合成路线流程图(无机试剂任
用)。合成路线流程图示例如下: