已知甲和乙在溶液中的转化关系如图所示: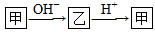 。请回答下列问题:
。请回答下列问题:
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________。该反应的热化学方程式为___________________________。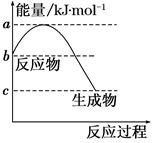
(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________0(填“>”、“<”或“=”)。
由糠醛A制备镇痛药莫沙朵林的合成路线如下: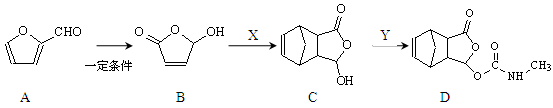
已知:最简单的Diels—Alder反应是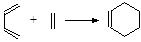
(1)糠醛与苯酚缩聚能生成高聚物糠醛树脂,写出反应化学方程式:______________。
(2)糠醛催化加氢后的产物为C5H10O2,与其互为同分异构体并属于羧酸,且烷基上一氯代物只有1种的有机物的系统命名为:_________________。
(3)已知B+X→C和C+Y→D都为加成反应,写出X与Y的结构简式:
X ____________________ Y _____________________ 。
(4)已知: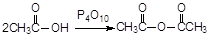 。请设计以
。请设计以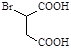 和
和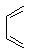 为原料合成化合物
为原料合成化合物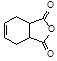 的实验方案。(用合成路线流程图表示为:A
的实验方案。(用合成路线流程图表示为:A B……
B…… 目标产物)。
目标产物)。
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中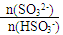 随pH变化的关系:
随pH变化的关系:
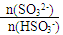 |
91:9 |
1:1 |
9:91 |
| 室温下pH |
8.2 |
7.2 |
6.2 |
(1)简述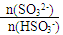 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) =" _______" mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式:。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62-……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:X  HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空:
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素C,N,O非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变 b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆 d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为______________。
(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范围;
② 若V=48,试计算混合物中CuS的质量分数(保留两位小数)。
药物E具有抗癌抑菌功效,其合成路线如下。
已知:NaBH4是一种很强的还原剂,可以将-C N还原为-CH2NH2
N还原为-CH2NH2
(1)关于化合物D的说法错误的是_______________
a.1molD最多可与3molH2发生加成反应 b.可以与盐酸发生反应
c.可以使高锰酸钾酸性溶液褪色 d.是烃的含氧衍生物
(2)反应③在水溶液中进行,HCl是催化剂,此反应中除了生成D外,还有一种产物,该产物的名称是_________________。
(3)E的结构简式为______________________。
(4)合成路线中设计反应①和③的目的是____________________________________________
(5)阅读以下信息,依据以上流程图和所给信息,以CH3CHO和CH3NH2为原料设计合成α-氨基丙酸【CH3CH(NH2)COOH】的路线。
已知:
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A→B→C…→H.