药物E具有抗癌抑菌功效,其合成路线如下。
已知:NaBH4是一种很强的还原剂,可以将-C N还原为-CH2NH2
N还原为-CH2NH2
(1)关于化合物D的说法错误的是_______________
a.1molD最多可与3molH2发生加成反应 b.可以与盐酸发生反应
c.可以使高锰酸钾酸性溶液褪色 d.是烃的含氧衍生物
(2)反应③在水溶液中进行,HCl是催化剂,此反应中除了生成D外,还有一种产物,该产物的名称是_________________。
(3)E的结构简式为______________________。
(4)合成路线中设计反应①和③的目的是____________________________________________
(5)阅读以下信息,依据以上流程图和所给信息,以CH3CHO和CH3NH2为原料设计合成α-氨基丙酸【CH3CH(NH2)COOH】的路线。
已知:
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A→B→C…→H.
H2O2是一种重要的氧化剂,亦具有还原性。下列① ~ ④个涉及H2O2的反应(未配平、条件略)。①Na2O2+ HCl→NaCl + H2O2②H2O2 →H2O + O2③Ag2O + H2O2 →Ag + O2 + H2O ④H2O2 + Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O。
据此,填写下列空白:( 1)配平上述反应④,并标出电子转移方向与数目。
1)配平上述反应④,并标出电子转移方向与数目。
[ ]H2O2 +[ ]Cr2(SO4)3+[ ]KOH→[ ]K2CrO4+[ ]K2SO4+[ ]H2O
当0.1mol氧化剂参加反应时,转移电子个。
(2)H2O2仅体现还原性的反应是(填代号),此反应中的氧化产物为。
(3)H2O2体现弱酸性的反应是(填代号),其理由为。
现有部分短周期主族元素的有关信息,如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
核外有5种不同能量的电子,其中有 2个未成对电子 2个未成对电子 |
| X |
最高化合价为+7价 |
| Y |
短周期主族元素原子中半径最大 |
| Z |
地壳中含量最多的金属 |
(1)T的一种单质相对分子质量为256,能溶于CS2,该单质的分子式为____________(用元素符号表示);指出T单质的一种用途_____________________________。
⑵写出Z氢氧化物的电离方程式:;下列酸中不能溶解Z单质的是。
a.浓硝酸 b.热浓硫酸 c.浓盐酸 d.稀硝酸
⑶可用于扑灭Y单质燃烧引起的火灾的物质是___________。
a.二氧化碳 b.水 c.沙土 d.干粉(主要成分为NaHCO3)
⑷.元素X元素T相比,非金属性较强的是__________(用元素符号表示)。下列表述中能证明这一事实的是____________。
a.在溶液中T的单质能置换出X的单质
b.X的气态氢化物比T的气态氢化物更稳定
c.T的无氧酸钠盐溶液pH>7,而X的+7价含氧酸钠盐溶液pH=7
大多金属碳化物能与水剧烈反应,生成相应氢氧化物和气态烃,如:Na4C+4H2O→4NaOH+CH4↑, MgC2+2H2O→Mg(OH)2+C2H2↑
现有CaC2与某常见金属碳化物A的混合物,与足量盐酸反应,得一澄清溶液,并有大量气体产生,将气体通过碱石灰干燥除杂后,测其体积为V1,将所得气体充分燃烧,生成的CO2的体积为V2,相同条件下,V1:V2=5:7:向澄清溶液中逐渐加入足量Na2CO3溶液后,再继续加入NaOH溶液,沉淀物质的量变化如下图所示,试回答下列问题:
(1)已知A中的金属元素是短周期元素,则该元素是:(写元素符号),写出CaC2与浓盐酸反应的化学方程式:;
(2)根据Vl:V2=5:7,可算出混合烃中平均每Imol烃分子含有____mol C,由此可知气态混合烃中含有乙炔和,
(3)A的化学式为;
(4)原混合物中CaC2的物质的量为mol, A的质量为g。
(14分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
填写下列空白:
(1) 甲中不含氧原子的官能团名称是__________;下列试剂能与甲反应而褪色的是__________ (填标号)。
a. Br2/CCl4溶液b.石蕊溶液c.酸性KMnO4溶液
(2) 甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式____________________
(3) 淀粉通过下列转化可以得到乙(C2H6O2)(其中A〜D均为有机物,A为一种单糖,B为一种有特殊香味的一元醇,C为一种气体)
B转化到乙的一系列反应中涉及到的反应类型有__________。
a.消去反应b.取代反应
c.加成反应d.加聚反应
B转化为C的化学反应方程式为______________________________
(4) 化合物丁仅含碳、氢、氧三种元素,其相对分子质量为110。丁与FeCl3溶液作用显现紫色,且丁分子中苯基上的一氯取代物只有一种。则丁的结构简式为_______________
(5) 已知:

利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________________________________________
(9分)A为单质,B、C、D、E为 与A含有相同元素的化合物,它们之间有如下转化关系:
与A含有相同元素的化合物,它们之间有如下转化关系: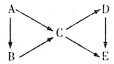
(1)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液均显碱性,且等浓度时碱性C〉D〉E,B可做供氧剂。
①B的电子式__________,C中含有的化学键类型为__________ (填“离子键”、“极性键”或“非极性键”)。
②A转化成C的离子方程式为: ______ ______________
______________
(2)若常温下A、B、C、D均为气体,且D为红棕色气体。
①I)物质的化学式:__________.写出B—C的化学方程式为____________________
②将B和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是:__________