H2O2是一种重要的氧化剂,亦具有还原性。下列① ~ ④个涉及H2O2的反应(未配平、条件略)。①Na2O2+ HCl→NaCl + H2O2 ②H2O2 →H2O + O2③Ag2O + H2O2 →Ag + O2 + H2O ④H2O2 + Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O。
据此,填写下列空白:( 1)配平上述反应④,并标出电子转移方向与数目。
1)配平上述反应④,并标出电子转移方向与数目。
[ ]H2O2 +[ ]Cr2(SO4)3+[ ]KOH→[ ]K2CrO4+[ ]K2SO4+[ ]H2O
当0.1mol氧化剂参加反应时,转移电子个。
(2)H2O2仅体现还原性的反应是(填代号),此反应中的氧化产物为。
(3)H2O2体现弱酸性的反应是(填代号),其理由为。
(4分) 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:
若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙。回答下列问题:
(1)乙的分子结构中一定含有的官能团是(填名称);丙的分子结构中一定含有的官能团的电子式为。
(2)乙、丙的相对分子质量之差为(填一个数字)的整数倍。
(3)满足上述转化关系的甲、乙、丙、丁中,相对分子质量最小的甲的结构简式为。
吲哚昔酚 (idoxifene)可用于治疗骨质疏松症,它的合成路线如图。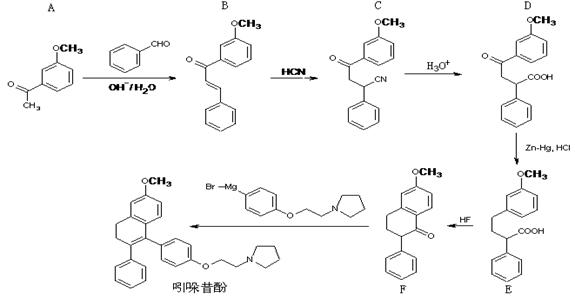
(1)化合物A的分子式是,1molA最多能与H2发生反应
(2)反应类型:B→C; D→E
(3)D中含氧官能团有:(写名称)。
(4)化合物E能发生的反应类型是(填入序号)
| A.加成反应 | B.酯化反应 | C.水解反应 | D.加聚反应 |
(5)E→F中还有一种副产物G生成,G与F互为同分异构体,且含有三个六元环,G 结构简式为:。
(6)满足下列四个条件的A的同分异构体数目有种。
①苯的衍生物,且苯环上只有两个互为对位的取代基;②能发生银镜反应;③与FeCl3溶液作用不显色;④不与氢氧化钠水溶液反应
(7)2,2-二甲基戊酸[CH3CH2CH2C(CH3)2COOH]是有机合成中间体,请设计合理的方案以丙酮(CH3COCH3)为唯一有机原料合成2,2-二甲基戊酸(用合成路线流程图表示,注明反应条件)
提示:①合成过程中无机试剂任选;②丙酮分子间能发生上图合成路线中A→B的类似反应;
③合成路线流程图示例:CH3CH2OH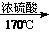 CH2=CH2
CH2=CH2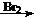 CH2Br-CH2Br
CH2Br-CH2Br
(9分)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A 与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。 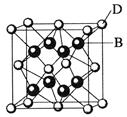
 (1)A的元素符号是;E在元素周期表中的位置是,它的+2价离子的电子排布式为。
(1)A的元素符号是;E在元素周期表中的位置是,它的+2价离子的电子排布式为。 (2)B的氢化物的晶体类型是晶体,B的氢化物与C的氢化物相比,分子极性较大的是(写化学式)。
(2)B的氢化物的晶体类型是晶体,B的氢化物与C的氢化物相比,分子极性较大的是(写化学式)。 (3)从图中可以看出,D跟B形成的离子化合物的电子式为;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
(3)从图中可以看出,D跟B形成的离子化合物的电子式为;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
(11分)现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 |
性质 |
| A |
一种核素的原子核内不含中子 |
| B |
原子核外电子有6种不同运动状态 |
| C |
最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D |
单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E |
在地壳中的含量位居第三 |
| F |
周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G |
该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
(1)画出元素C的基态原子核外电子排布图:;G元素位于周期表的区;
B、C、D三种元素的第一电离能由大到小顺序为:(用元素符号表示)。
(2)化合物BA2D2蒸气293 K时,理论测算密度为2.0g·L-1,实际密度为2.5 g·L-1的原因是。
(3)FD2中F原子的杂化类型为;分子空间构型为;FD2易溶于水的原因可能是:(填入序号)。①FD2与水极性相同②FD2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A.氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.氯化硼遇水蒸气会产生白雾 | D.氯化硼分子属极性分子 |