氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
| T /K |
298 |
398 |
| 平衡常数K |
K1 |
K2 |
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)﹥c(NH4+) b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲硅烷(SiH4)的结构与甲烷相似。SiH4分子为________分子(填极性或非极性),SiH4分子中H原子的1s轨道与Si原子的sp3轨道重叠形成Si—H_____ (填“σ键”或“π键”);甲硅烷能与硝酸银发生如下反应:SiH4 + 8AgNO3 + 2H2O=8Ag↓ + SiO2↓ + 8HNO3,该反应中氢元素被氧化,则SiH4充当_______剂(填氧化或还原),由此可判断电负性:SiH(填“>”、“<”或“=”)。
(2)下图中,能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是___填标号)。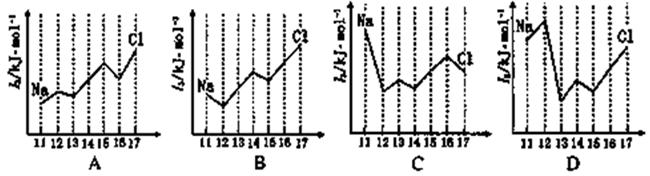 (3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。
(3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。
②石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是(填“阳离子”、“阴离子”或“自由电子”)。
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l)  CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。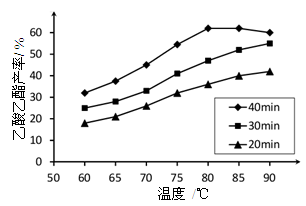
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
I:已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:T℃时物质的浓度(mol•L-1)变化
| 时间/ min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 ,T℃时该化学反应的平衡常数是 。在该温度下,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和2.0mol H2,则反应向 进行。(填“正反应方向”或“逆反应方向”)。
(2)已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol•L-1,则CO在此条件下的转化率为 ,如果保持体积不变向该密闭容器中再充入1 mol氩气,平衡时CO的转化率(填“变大”“不变”“变小”)。
(3)397℃时该反应的平衡常数为12,请判断该反应的△H 0(填“<”、“>”或“=”)。
Ⅱ:工业上可用CO和H2在一定条件下合成甲醇,反应为:
CO(g)+2H2(g) CH3OH(g)ΔH=Q kJ•mol-1
CH3OH(g)ΔH=Q kJ•mol-1
现在容积均为2L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
(1)该反应的Q0(选填“<”、“>”或“=”,下同),K1K2。
(2)300℃时,该反应的平衡常数为。
(3)将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有:____________
(至少答2种) 。
根据下列化合物:①NaOH,②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4, ⑨NH3•H2O,请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;
在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6 mol•L-1] | D.向水中加入NH4Cl固体 |
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 mn (填“<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)___ ___。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
短周期元素A、B、C、D原子序数依次增大,且A是短周期元素中原子半径最小的元素。A、C位于同一主族,B的最外层电子数次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等。请回答下列问题:
(1)D与C的最高价氧化物对应水化物反应的化学方程式为。
(2)A和C形成的化合物的电子式为;B、C形成的化合物中稳定性较强的物质其阴、阳离子的个数比为。
(3)与B同主族的元素E与D的氢化物稳定性。