以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验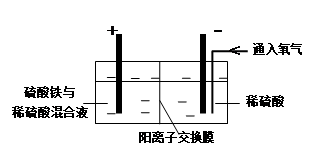
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。
(14)已知:①双键在链端的烯烃发生硼氢化一氧化反应,生成的醇羟基在链端:
R-CH=CH2 R-CH2CH2OH
R-CH2CH2OH
②RCH2CHO +R'CH2CHO 
化合物M是一种香料,可用如下路线合成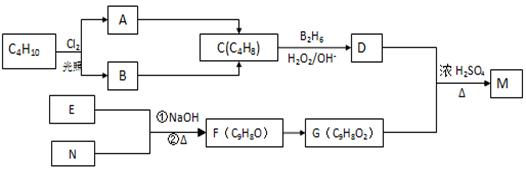
已知:核磁共振氢谱显示E分子中有两种氢原子,F为芳香化合物。请回答下列问题:
(1) 写出反应A→C的反应条件:___________ __________。
(2). 原料C4H10的名称是_________ _____(系统命名)。
(3) 写出M的结构简式:________ ___。
(4) 写出E和N生成F的化学方程式:__________________________。
(5) 写出D和G生成M的化学方程式:_______ __________________。
天然维生素P(结构如下图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是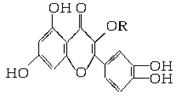
| A.可与溴水反应,且1 mol该物质与足量溴水反应消耗6 mol Br2 |
| B.可与NaOH溶液反应,1 mol该物质可与5 mol NaOH反应 |
| C.一定条件下1 mol该物质可与H2加成,耗H2最大量为6 mol |
| D.维生素P能发生水解反应 |
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
x CuCO3 •y Cu(OH)2(x、y为正整数且x≤2,y≤2)。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4︰1;石青则为3︰1。请推算它们的化学组成(化学式)。
孔雀石:;石青:。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 4.48L(标准状况下);加热另一份样品使其完全分解,得到CuO28g,试通过计算确定该混合物中孔雀石和石青的物质的量之比为。
(12分)某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为较合理的途径及理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了 和
和 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:
、 。
(5)途径④发生反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
(8分)有机物A、B、C、D有如下性质。
(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA
和1mol NaHCO3能完全反应,则A的结构简式是。
写出与A具有相同官能团的A的所有同分异构体的结构简式
。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是
。