乙酸乙酯是重要的化工原料。实验室合成乙酸乙酯的装置如下图所示。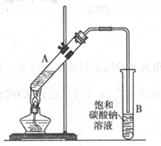
有关数据及副反应: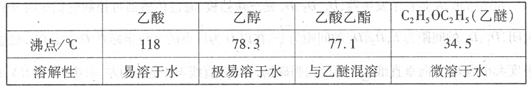
副反应:
C2H5OH+C2H5OH C2H5OC2H5+H2O
C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6 mL乙醇、4 mL乙酸和4 mL浓硫酸,这三种试剂的添加顺序依次为 _______、_______ 、_______
(2)试管B中导管接近液面未伸入液面下的理由是 _______
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入 _______(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡。加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集_______0C左右的液体即得纯净的乙酸乙酯。
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有____________________
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释: ___ _______________
为了比较卤素单质的氧化性强弱可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2)并将Cl2依次通入NaBr溶液和KI淀粉溶液中。如图所示仪器及药品试回答: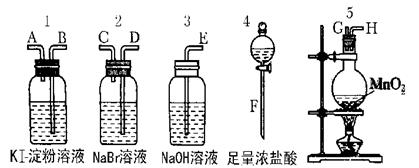
(1)若所制取气体从左向右流向时上述仪器接口的连接顺序为F接G、H接______、______接______、A接E。
(2)实验开始后装置5中反应的化学方程式为______________________。
(3)装置3的作用是________________________
反应的离子方程式为______________________________________。
(4)装置1中产生的现象是___________ 反应的离子方程式为____________________。
(5)若溴离子的还原性弱于碘离子的还原性,通过实验,卤素单质的氧化性由强到弱的顺序为__________________。
实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置:
填写所示仪器名称AB
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是;
装置E中足量酸性KMnO4溶液的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号)
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据如下:
| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2 g |
无其他物质 |
|
| ⑤ |
1.2 g |
CuO 0.5 g |
|
| ⑥ |
1.2 g |
MnO2 0.5 g |
回答下列问题: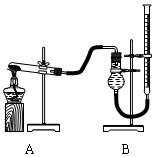
⑵上述实验中的“待测数据”指;
⑶若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,;
⑷为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.,
b.CuO的化学性质有没有改变。
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_ ,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是。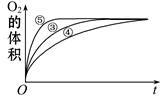
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是。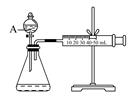
(4)H2O2能氧化H2SO4酸化的FeSO4,离子方程式为;
某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)____________。
(2)判断到达滴定终点的实验现象是:_________________。
(3)操作步骤B的意义:。
(4)下面a~e是中学化学实验中常见的几种定量仪器:a 量筒;b 容量瓶;c 滴定管;d 托盘天平;e 温度计
①.其中标示出仪器使用温度的是________________(填写编号);
②.由于错误操作,使得到的数据比正确数据偏小的是_____________(填写编号);
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面度数
C.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
D.用待测溶液润洗锥形瓶