H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_ ,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。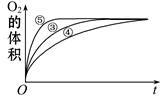
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。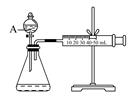
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】Mg2+检验的方法:取 2 滴待检液,加入 2 滴 2mol/LNaOH 溶液,再加入 2 滴镁试剂(I)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有 Mg2+。注:Ag+、Cu2+、Fe3+、NH4+会妨碍 Mg2+的检测,Mg(OH)2可溶于 浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。
【探究思路】确定该焰火原料所含金属种类
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 序号 |
实验步骤 |
实验现象 |
结论 |
| ① |
取少量该焰火原料,加入冷水 |
无明显现象 |
|
| ② |
取少量该焰火原料,加入稀盐酸 |
完全溶解,大量气体产生、溶液呈无色 |
(2)乙同学取甲同学第②组实验的溶液,加入镁试剂(I)染料,未见天蓝色物质。他得出合金中不含镁离子的结论。乙同学的结论(填“正确”或“错误”)你的理由是
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下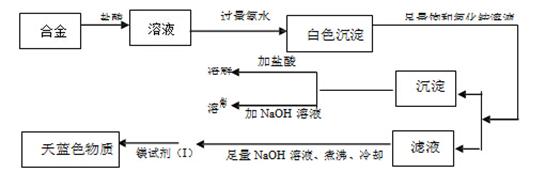
由丙同学的实验记录可知该焰火原料是由和两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是
化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究。
查得资料:该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成;其他成分遇到盐酸时无气体生成。进行实验:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。依据实验过程回答下列问题: 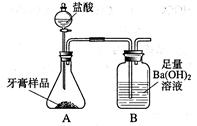
(1)准确称取8.00 g样品三份,进行测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为。
(2)整个装置不漏气:①若计算值比实际值偏小,分析其原因
;
②若计算值比实际值偏大,分析其原因;
改进措施是。
在A、B、C、D四支试管中分别盛有NaHSO4、Na2CO3、BaCl2、BaCO3固体,某同学在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来。
(1)NaHSO4在水中会解离出Na+、H+、SO42-。从物质分类的角度考虑,NaHSO4属于()
A.酸 B.碱 C.盐 D.氧化物
(2)最先检验出来的固体物质是,利用它又可直接检验出的固体物质是()。
(3)剩余两种固体被检验出来时发生反应的化学方程式分别是:
、。
海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)用海水提取氯化钠,常先通过蒸发除水得到粗盐,再除去泥沙可得到精盐,精盐中仍含有少量的CaCl2、Na2SO4杂质。除去精盐中的上述杂质,可先加入稍过量溶液,再加入稍过量的溶液,然后再经过滤,滤掉的沉淀中含有。滴加适量的、蒸发、结晶,即可得到纯净的氯化钠。
(2)从海水中提取溴常用吹出法,即用氯气(C12)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下: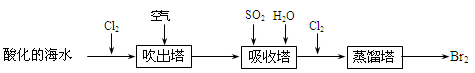
①写出氯气从NaBr中置换出溴单质的化学方程式:;该反应开始时在pH=3的酸性条件下进行,可用测定开始时反应液的酸碱度。
②吹出的溴和大量空气混合在一起进入吸收塔(吸收塔中发生的反应:Br2+SO2+2H2O = H2SO4+2HBr)。根据流程图分析,通入SO2和水的目的是。
实验室制取硝基苯的主要步骤如下:
① 配置一定比例的浓硫酸和浓硝酸的混合物,加入反应器
② 向室温下的混合液中逐滴加入一定量的苯,充分振荡,混合均匀
③ 在50-60℃条件下发生反应,直到反应结束
④ 除去混合酸后,粗产品依次用蒸馏水和5﹪NaOH溶液洗涤,最后用蒸馏水洗涤
⑤ 将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯
填写下列空白:
① 配置一定比例的浓硫酸和浓硝酸的混合液时,操作注意事项是
② 步骤③中,为了使反应在50-60℃下进行,常用的方法是。
③ 步骤④中洗涤、分离粗硝基苯使用的仪器是。
④ 步骤④中粗产品用5﹪NaOH溶液洗涤的目的是。
⑤ 此反应可表示为。