化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式 ,该分子属
于 (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式: 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
有如下物质间的转化关系图: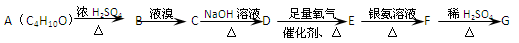
已知1mol G与足量金属钠反应可以得到标况下22.4 L氢气。请回答下列问题:
⑴C4H10O的同分异构体中属于醇类的有种,属于醚类的有种。
⑵写出下列物质的结构简式:
BDF
⑶写出下列化学反应方程式:
C→D;D→E
有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:
①1molX与足量金属Na反应产生1.5mol气体,1molX最多可以与2molNaOH溶液反应。
② X与醇或羧酸在浓硫酸和加热的条件下均生成有香味的产物。
③ X在一定条件下发生消去反应所得产物可与溴水发生加成反应。
④X不能发生水解反应。
⑤ X的1H核磁共振谱图有3种峰.
(1)写出X的结构简式
(2)写出X与钠、乙醇、乙酸的反应及X的消去反应
;
;
下图中A、B、C、D、E、F、G均为有机化合物。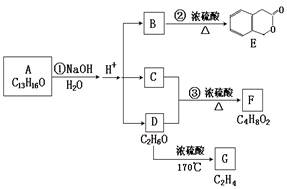
(1)写出反应②的化学反应方程式 。
(2)A的结构简式是 ,反应①的反应类型是
(3)符合下列三个条件的B的同分异构体的数目有 个。
①含有邻二取代苯环结构;②与B具有相同的官能团;
③不可与FeCl3溶液发生显色反应
(4)写出D→G反应方程式
(1)写出下列反应的离子方程:
①在NaOH溶液通入少量二氧化碳:。
②向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:。
(2)软锰矿(MnO2)和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,写出软锰矿制备K2MnO4的化学方程式,并标出电子转移的方向和数目:
下面是某同学研究氯气性质过程中的一个片断。请你帮助他完成部分实验并补全实验记录。
[观察]氯气的颜色、状态:色状态;闻氯气的气味:气味。
[预测]氯气是一种非金属单质,它可能具有性质有。
从元素化合价的角度分析,它可能具有性质有。
[实验探究]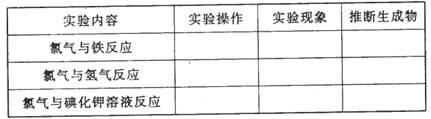
[实验结论]
(1)通过比较氯气和曾经学习过的氧气等非金属单质的性质,可推知氯气的化学性,能与反应。
(2)在上述过程中,该同学都用到了哪些研究物质性质的方法?
。
(3)说明闻气体气味的方法。。