不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
| x值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于______周期________族(放射性元素除外)。
把煤作为燃料可通过下列两种途径获得热量:
途径I:直接燃烧:C(s)+O2(g) CO2(g) (放热393.5kJ)
CO2(g) (放热393.5kJ)
途径Ⅱ:先制成水煤气,再燃烧水煤气:
C(s)+ H2O(g)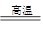 CO(g)+H2(g) (吸热131.5kJ)
CO(g)+H2(g) (吸热131.5kJ)
CO(g)+1/2O2(g) CO2(g), H2(g)+ 1/2O2(g)
CO2(g), H2(g)+ 1/2O2(g) H2O(g) (共放热525kJ)
H2O(g) (共放热525kJ)
试回答下列问题:
(1)判断途径I放出的总热量______(填“大于”、“等于”或“小于”)途径Ⅱ放出的总热量。
(2)在制水煤气的反应里,反应物所具有的总能量______生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要______能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是;
①使煤充分燃烧,提高能量的转化率②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气④减少CO2的产生,避免“温室效应”
有下列各组物质
| A.O2和O3 |
| B.12C和14C |
C.CH3—CH2—CH2—CH3和 |
D.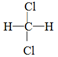 和 和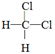 E.甲烷和庚烷 E.甲烷和庚烷 |
(1)_________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;
(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“否”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。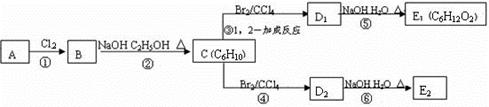
反应②的化学方程式为;C的化学名称是;
E2的结构简式是;④、⑥的反应类型依次是。
2000 年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。苯丙醇胺(英文缩写为PPA)结构简式如下: 其中φ代表苯基。苯丙醇胺是一种一取代苯,取代基是
其中φ代表苯基。苯丙醇胺是一种一取代苯,取代基是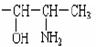
(1)PPA 的分子式是:_______________________。
(2)它的取代基中有两个官能团,名称是_________基和________基(请填写汉字)。
(3)将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,其中5 种的结构简式是:
请写出另外4 种同分异构体的结构简式(不要写出-OH 和-NH2 连在同一个碳原子上的异构体;写出多于4 种的要扣分):
______________、______________、______________、______________。
实验室做乙醛和银氨溶液反应的实验时:
(1)为了得到光亮的银镜,试管应先用溶液煮沸,倒掉煮沸液体后再用蒸馏水将试管冲洗干净。
(2)配制银氨溶液时向盛有溶液的试管中逐滴滴加溶液,边滴边振荡,直到为止。有关反应的化学方程式为:①;②。
(3)加热时应用加热。产生银镜反应的化学方程式。