化合物Ⅰ是重要的化工原料,可发生下列反应生成Ⅲ
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下: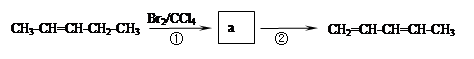

(1)a的结构简式是______________________,②步的反应类型是_______________。
(2)化合物I的一种同分异构体是天然橡胶的单体,用系统命名法命名该单体___________。
(3)化合物Ⅰ与II反应还可能得到III的一种同分异构体,该物质的结构简式为__________。
(4)欲检验化合物Ⅲ中的碳碳双键,正确的试剂是_______________________。
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.O2比O3的质量小 |
| C.两种气体的分子数目相等 | D.两种气体的氧原子数目相等 |
下列物质中属于纯净物的是
①由同种元素组成的物质②具有固定熔沸点的物质③由相同种类和相同数目的原子组成的分子④只有一种元素的阳离子和另一种元素的阴离子组成的物质⑤在氧气中燃烧只生成二氧化碳的物质⑥只含有一种分子的物质
| A.②③⑥ | B.④⑤⑥ | C.①④ | D.②⑥ |
 已知,下列反应可以发生:Br2+H2SO3+H2O=2HBr+H2SO4,在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于
已知,下列反应可以发生:Br2+H2SO3+H2O=2HBr+H2SO4,在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075mol/L | B.0.0018mol/L | C.0.075mol/L | D.0.08mol/L |
 取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
| A.KClO3在反应中失去电子 | B.ClO2是氧化产物 |
C.H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2 mol电子转移 |