 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是 
| A.KClO3在反应中失去电子 | B.ClO2是氧化产物 |
C.H2C2O4在反应中被氧化 | D.1mol KClO3参加反应有2 mol电子转移 |
(共12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示: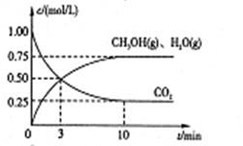
(1)从反应开始到平衡,氢气的平均反应速率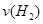 =mol/(L·min)
=mol/(L·min)
(2)该条件下CO2的转化率为。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是。
| A.升高温度 | B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: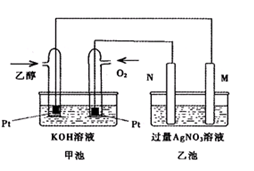
(1)M极的电极材料为 。
(2)加入乙醇的铂电极的电极反应式为。
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池溶液的体积为400mL,则乙池中溶液的pH为。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为。
有机物分子组成和结构的表示方法具有多样性。
(1)某有机物X的结构简式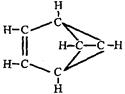 可以用键线式简单表示为
可以用键线式简单表示为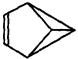 。则下列与X互为同分异构体的是;
。则下列与X互为同分异构体的是;
A.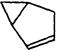 |
B. |
C. |
D. |
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”。则 doggycene的分子式为________;该分子中所有碳原子________(填“可能”或“不可能”)处于同一平面。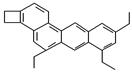
(3)2-甲基-1-丁烯的键线式为。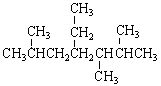 (按系统命名法)名称为。
(按系统命名法)名称为。
空气质量高低直接影响着人类的生产和生活,计入《空气质量日报》空气污染指数的项目有SO2、CO、氮氧化物和可吸入颗粒物等。请回答下列问题:
⑴氮氧化物进入大气后,不仅会与水反应形成硝酸型酸雨,还可能形成光化学烟雾。
①N、O的电负性大小关系为NO(选填“>”、“=”或“<”)。
②H2O分子中O原子的杂化类型。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出26Fe原子的基态电子排布式。
②CO有多种等电子体,写出其中常见的一种为。
⑶为减轻SO2污染,火力发电厂常在燃煤中加入CaO“固硫”。
①CaO晶胞如图所示,其中O2- 周围等距离且最近的Ca2+有个。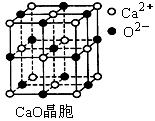
②CaO晶体和NaCl晶体中离子排列方式相同,CaO晶体的熔点NaCl晶体的熔点(填“高于”、“等于”或“低于”)。
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液,pH的变化如图1所示。
⑴根据图1,用化学符号表示滴定过程中溶液中微粒之间的关系
①点a处: c(CH3COO-)+c(CH3COOH) =。
②点b处:溶液中离子浓度大小关系:。
③点c处:c(CH3COOH)+c(H+) =。
⑵甲同学也用0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液进行滴定实验,该同学所绘制的滴定曲线如图2所示。图2中有一处明显错误,请指出错误的原因:
。
⑶乙同学设计了用0.1000 mol·L-1标准盐酸滴定20.00mL未知浓度氨水的中和滴定实验。
①0.1000 mol·L-1标准盐酸应盛放在(填仪器名称)中。
②为减少实验误差,指示剂应选用:。
③滴定过程中眼睛始终注视。
④若实验中锥形瓶用待盛放的未知浓度氨水润洗,则测定结果将。(选填“偏高”、“偏低”或“不影响”)
⑷实验室配制pH相等的CH3COONa溶液、NaOH溶液和Na2CO3溶液,三种溶液中溶质的物质的量浓度分别为c1、c2、c3,比较c1、c2、c3的大小关系:
<<。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
⑴在一定体积的密闭容器中,进行化学反应: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
①该反应正向反应是反应。(填“放热”或“吸热”)
②能判断该反应达到化学平衡状态的依据是。
| A.容器压强不变 | B.混合气体中c(CO2)不变 |
C.υ正(H2)=υ逆(H2O) | D.c(CO2)=c(CO) |
③当其他条件不变时,若缩小容器的体积,该反应平衡移动。(选填“正向”、“逆向”或“不”)
⑵工业上合成甲醇可在密闭容器中采用如下反应进行:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
①该反应的平衡常数表达式K=。
②某实验将1molCO2和3molH2充入一定体积的密闭容器中,在两种不同条件下发生反应(只有一种条件不同)。测得CH3OH的物质的量随时间变化如图所示:
曲线I、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(选填“>”、“=”或“<”)。
③一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2、3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
经测定甲容器经过5min达到平衡,平衡时CO2的转化率为50%,甲容器中该反应在5min内的平均速率υ(H2)=mol·L-1·min-1。
要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为。