I. 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
| 酸 |
电离平衡常数K |
| CH3COOH |
1.76×10-5 |
| H2CO3 |
K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列问题:
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(2)等浓度的下列溶液中由水电离出的OH-浓度由大到小的顺序是__(用序号作答)
①CH3COONa ②NaH2PO4 ③NaHPO4 ④NaHCO3 ⑤Na2CO3
(3)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=_____。
II.已知t℃时,Kw=1×10 ;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
;在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=________。
III.现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯:

25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
4.7 |
| 完成沉淀pH |
3.2 |
9.7 |
6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是_____________(填序号)
A.酸性高锰酸钾溶液 B.NaClO溶液 C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 。
(2)调节pH约4应该加入的物质可以是 。
A.CuO B.CuCl2 C.Cu(OH)2 D.NaOH
利用平衡移动原理简述加入该物质的理由 。
(3)最后能不能直接蒸发结晶得到CuCl2·2H2O?__________(填“能”或“不能”)。如不能,应如何操作?(若能,此空不填) 。
已知:
① 有机化学反应因反应条件不同,可生成不同的有机产品。例如:
② 苯的同系物与卤素单质混合,若在光照条件下,侧链烃基上的氢原子被卤素原子取代;若在催化剂作用下,苯环某些位置上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为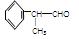 的物质,该物质是一种香料。
的物质,该物质是一种香料。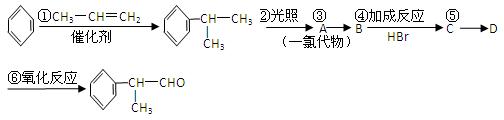
请根据上述路线,回答下列问题:
(1)A的结构简式可能为。
(2)反应③的反应类型为。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件,下同):
。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取将A直接转化为D的方法,其原因是。
(5)检验产品中官能团的化学反应方程式为:。
(6)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②苯环上的一溴代物有两种;③分子中没有甲基。写出符合上述条件的物质可能的结构简式(只写两种):
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。
除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是
CO(g)+H2(g),此反应是
吸热反应。
① 此反应的化学平衡常数表达式为,;
②下列能增大碳的转化率的措施是;
| A.加入C(s) | B.加入H2O(g) | C.升高温度 | D.增大压强 |
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) △H=-519KJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) △H=-519KJ/mol。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是(填“X”或“Y”或“Z”),选择的理由是;
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:
2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正v逆 (填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =mol-1·(Lmin)-1。
(4)生产过程中,合成气要进行循环,其目的是。
短周期主族元素A、B、C、D、E在元素周期表中的位置如下图所示:
请回答下列问题: (1)B、C、D元素电负性的大小顺序为:______>______>______(填元素符号)。
(1)B、C、D元素电负性的大小顺序为:______>______>______(填元素符号)。 (2)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________________________________.
(2)E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________________________________. (3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________.
(3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________. (4)在298K下,A、B的单质各1mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3molB的单质,则该反应在298K下的
(4)在298K下,A、B的单质各1mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3molB的单质,则该反应在298K下的 =(注:题中所设单质均为最稳定单质)
=(注:题中所设单质均为最稳定单质) (5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是
(5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是
(6)用A、B的单质作电极,C的最高价氧化物的水化物稀溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式。(假设C只被还原至+2价)
DAP—A树脂是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥;对环境及人员无损害;性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。这种材料可采用下列合成路线: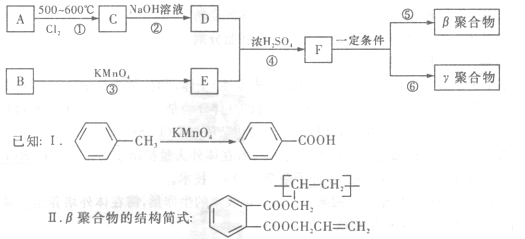
试回答下列问题:
(1) 在①〜④的反应中属取代反应的是(2分)。
(2) 写出反应②的化学方程式(2分)。
(3) 写出反应⑤的化学方程式 (3 分)。
(4) 工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是(2分)(2分)。
(5) 写出B分子中苯环上的氢被氯取代所得二氯代物的各种结构简式 (4 分)。
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各
元素中电负性最大。请回答下列问题:
(1) X、Y的元素符号依次为 (1分)、 (1分);
(2) XZ2与YZ2分子的立体结构分别是V形(1分)和直线形(1分),相同条件下两者在水中的溶解度较大的是 (1分)(写分子式)’理由是因为 (2分);
(3) Q的元素符号是 (1分),它属于 周期,它的核外电子排布式为 (1分),在形成化合物时它的最髙化合价为 (1分);
(4) 用氢键表示式写出£的氢化物溶液中存在的所有氢键 (4 分)。