工业上采用乙烯和水蒸气合成乙醇的原理为:CH2=CH2(g) + H2O(g)  CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )
CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )
| A.该反应为吸热反应 |
| B.工业上采用7MPa左右,250~300℃,是综合考虑反应速率和乙醇的产率等因素的结果 |
| C.相同温度下,压强越大,乙烯的转化率越大,平衡常数越大 |
| D.给予足够的压强和适当的温度,可实现乙烯的转化率为 100% |
学习化学过程中需要经常做实验。下列实验操作正确的是[ ]
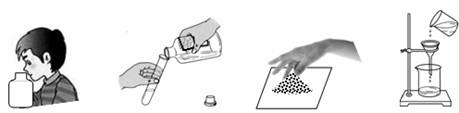
| A.闻气味 | B.倾倒液体 | C.取粉末 | D.过滤 |
下列变化需加入还原剂才能完成的是(→代表转化)[ ]
| A.NO3-→ NO | B.CO2→HCO3- |
| C.HS-→ S2- | D.MnO2→MnO4- |
V L硫酸铝溶液中含有Al3+mg,则溶液中SO42-的物质的量浓度为[ ]
A. mol/L mol/L |
B.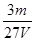 mol/L mol/L |
C.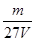 mol/L mol/L |
D.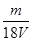 mol/L mol/L |
用右图表示的一些物质或概念间的从属关系中不正确的是[ ]
| X |
Y |
Z |
|
| 例 |
氧化物 |
化合物 |
纯净物 |
| A |
置换反应 |
氧化还原反应 |
化学反应 |
| B |
胶体 |
分散系 |
混合物 |
| C |
电解质 |
离子化合物 |
化合物 |
| D |
碱性氧化物 |
金属氧化物 |
氧化物 |
下列说法正确的是[ ]
| A.CO2的摩尔质量为44g |
| B.5.4mL4℃的H2O中有1.806×1023个分子 |
| C.标准状况下,2.24L CCl4所含的原子数为0.5NA |
| D.50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol |