A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
| 元素 |
相关信息 |
| A |
A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B |
是空气中含量最丰富的元素 |
| C |
短周期中,单质C的金属性最强 |
| D |
基态原子第三能层上有7种运动状态不同的电子 |
| E |
一种核素的质量数为63,中子数为34 |
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为 。
(2)H—A、H—B两种共价键中,键能较大的是 ;H—A、H—D两种共价键中,键的极性较强的是
(3)E位于周期表中的位置是 ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式 。
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为 。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
(9分)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,A是红棕色粉末,G是气体,J是黑色晶体。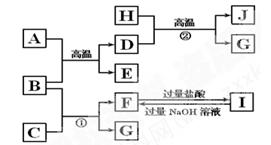
根据图示回答问题:
(1)写出下列物质的化学式:A ,E,I;
(2)反应②的化学方程式是;
(3)J与盐酸反应的化学方程式是;
产生等物质的量G分别消耗单质D与B 的物质的量之比
现有A、B、C、D、E、五种化合物,已知它们的阳离子有K+、Ag+、Ba2+、Fe2+、Al3+ 阴离子有Cl-、OH-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-、OH-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C呈碱性,且碱性为A> C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向E 溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验④中反应的化学方程式是。
(2)写出下列四种化合物的化学式:
A,CD,E。
(7分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA-
H++HA- HA- H++A2-
H++A2-
已知相同浓度时的电离程度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) c(H+)最大的是
(2)在0.01mol.L-1的NaHA溶液中2C(A2- )+(C(HA-)+C C(OH-)-C(H+)=
(3) 0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合显性原因
(用离子方程式表示)
(5分).在广口瓶内CH4与Cl2混合光照观察到的现象
反应后最多的产物是;写
出在生成物中有极性键构成的非极性分子的电子式1molCH4与Cl2反应生成了等物质的量四种有机产物共消耗Cl2mol
(5分)某种电池的电极材料为Al和Mg,电解质溶液为KOH,
(1) 电池的负极的电极反应式为__________
正极发生的是_______________反应(填反应类型);
(2) 总反应______________________________________________________________。