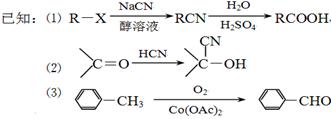
现用如下方法合成高效、低毒农药杀灭菊酯(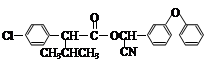 ) :
) :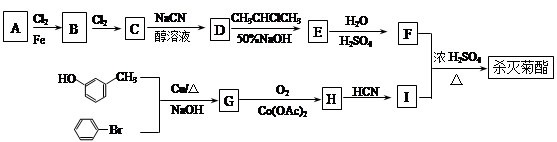
(1)按照系统命名法命名,B的名称是_____________;合成G的反应类型是__________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A与苯互为同系物
b.A的核磁共振氢谱有5个峰
c.充分燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应 F+I→杀灭菊酯的化学方程式:_____ ______________。
(4)写出C在高温高压、催化剂条件下与足量氢氧化钠水溶液充分反应的化学方程式:
_________ _____
(5)D在硫酸存在下发生水解生成J:D 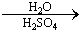 J
J
写出符合下列要求的J的所有同分异构体的结构简式: _。
①苯环上有两个位于间位的取代基;②能水解成两种有机物;③可以银镜反应。
(6)X与F互为同分异构体,X苯环上有三个取代基且含有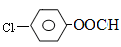 结构,则符合此条件的F共有 种。
结构,则符合此条件的F共有 种。
右图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: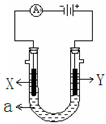
(1)若X、Y都是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,在X极附近观察到的现象是________;Y电极上的电极反应式是________,将Y电极反应产物通入Na2S溶液观察到的现象是________。电解NaCl溶液的离子方程式是________________。某厂现有50台电解槽,每台平均每天消耗2.925×105 g食盐,电解生成的Cl2与H2按体积比1:1.15合成质量分数为36.5%的盐酸。不考虑损耗,理论上一天可生产36.5%的盐酸t。(保留三位有效数字)
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为,工作一段时间后pH将(填“增大”或“减小”或“不变”)
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的氧化物,实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:
(1)写出Cu2(OH)2CO3在水中的沉淀溶解平衡方程式,溶液A的金属离子有Cu2+、Fe2+、Fe3+。检验溶液A中Fe3+的最佳试剂为,试剂①为(从下列所给字母中选填,下同)
a.KMnO4 b.KI c.H2O2 d.KSCN
(2)写出溶液A到溶液B的离子方程式_________
(3)试剂②是CuO,还可以是下列的,作用是。
a.CuCl2 b.CuCO3 c.Cu(OH)2 d.CuSO4
(4)沉淀C的化学式为。
(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
| 滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL |
| 1 |
25.00 |
20.02 |
| 2 |
25.00 |
17.10 |
| 3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)
(12分)(1)氯化铁水解的离子方程式为,向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是白色沉淀转变为红褐色沉淀。产生该现象的原因是。
(3)25℃,向100mL pH=12的NaOH溶液加入pH=10的NaOH溶液1000 mL,混合后溶液体积1100 mL ,pH=。
(4)常温下,将0.1000 molL-1 NaOH溶液滴入20.00 mL 0.1000 molL-1的一元弱酸HA溶液中,刚好完全反应,则c(Na+)c(A-)。(填“>”、“<”或“=”)
(5)某有机物结构为 ,它的含氧官能团名称为、。
,它的含氧官能团名称为、。
(每空1分,共10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为;另一种只由B组成的离子与AC2互为等电子体,其化学式为。
(4)E的核外电子排布式是,ECl3形成的配合物的化学式为。
(5)D单质晶体堆积为____________________。用●表示D原子,在方框内画出其晶胞图。