许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g)△H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠKⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其发生可逆反应的方程式为。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,请写出该电极反应的方程式为。
Ⅰ.有机物A的结构简式为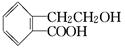 ,它可通过不同化学反应分别制得B、C和D三种物质。
,它可通过不同化学反应分别制得B、C和D三种物质。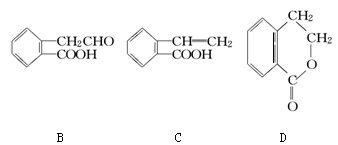
(1)B中含氧官能团的名称是________。
(2)A →C的反应类型是________;A~D中互为同分异构体的是________。
(3)由A生成B的化学方程式是______________________________________。
Ⅱ.某芳香族化合物H常用作防腐剂,H可利用下列路线合成:
已知:①A是相对分子质量为92的烃;
②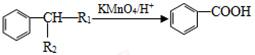
③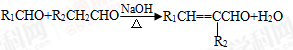 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);
④D的核磁共振氢谱表明其有两种不同化学环境的氢(两种不同位置的氢原子),且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________。
(2)同时符合下列条件的E的同分异构体共有____________种。
①分子中含有苯环
②能发生银镜反应
③能与FeCl3溶液发生显色反应
(3)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为______。
(4)H的结构简式为_____________________________________。
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。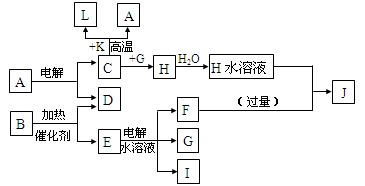
请回答:
(1)工业上制C用A不用H的原因。
(2)写出C与K反应的化学方程式,该反应的反应物总能量(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式。
(4)写出E物质的电子式。
(5)J与H反应的离子方程式为。
(6)写出G与熟石灰反应制取漂白粉的化学方程式。
(本题12分)某化学科研小组研究在其他条件不变时,改变某一反应条件对反应[可用aA(g)+bB(g)  cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
cC(g)表示]化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率,φ表示体积分数):
(1)在反应Ⅰ中,若p1>p2,则此正反应为(填“吸热”或“放热”)反应,也是一个气体分子数(填“减小”或“增大”)的反应。由此判断,此反应自发进行必须满足的条件是。
(2)在反应Ⅱ中,T1T2(填“>”、“<”或“=”),该正反应为(填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T2>T1,则此正反应为(填“吸热”或“放热”)反应。
(4)反应Ⅳ中,若T1>T2,则该反应能否自发进行?。
(本题10分)工业合成氨N2+3H2 2NH3反应过程中的能量变化如图所示,据图回答下列问题:
2NH3反应过程中的能量变化如图所示,据图回答下列问题:
(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低,理由是。
(2)该反应的平衡常数表达式为:K=,当浓度商QcK(填“<”、“>”或“=”)时,反应向右进行。
(3)450 ℃时该反应的平衡常数500 ℃时的平衡常数(填“<”、“>”或“=”)。
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有(填字母序号)。
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3