下列溶液中各微粒的浓度关系正确的是
| A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ |
| B.pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —)>c(K+)-c(CH3COO—) |
| C.0.2 mo1·L —1的Na2CO3溶液:c(OH—)=c(HCO3—)+c(H+)+2c(H2CO3) |
| D.0.2 mo1·L —1 HCl与0.1 mo1·L —1 NaAlO2溶液等体积混合:c(Cl—)> c(Na+)>c(Al3+)>c(H+)>c(OH—) |
下列说法中正确的是
| A.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
B.常温下,反应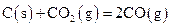 为熵增反应,可以自发进行 为熵增反应,可以自发进行 |
C.熵增加且放热的反应一定是自发反 应 应 |
| D.非自发反应在任何条件下都不能实现 |
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,各投入0.65 g锌粒,则下图所示比较符合客观事实的是
常温下,若使pH=3的盐酸与pH=9的Ba(OH)2溶液混合使其成为pH=7的溶液,混合时两溶液的体积比为
| A.1∶60 | B.3∶1 | C.100∶1 | D.1∶100 |
下列是一些同学学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
| A.怎样在一定时间内快出产品是运用了化学反应速率理论 |
| B.怎样使用有限原料多出产品是运用了化学平衡理论 |
| C.怎样提高原料转化率是运用了化学反应速率理论 |
| D.怎样使原料尽可能多地转化为产品是运用了化学平衡理论 |
下列溶液中加入少量NaOH固体导电能力变化不大的是
| A.盐酸 | B.CH3COOH | C.NH3·H2O | D.H2O |