实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是( )
| A.若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳。 |
| B.利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果; |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次; |
| D.用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种; |
下面是某化学活动小组在研究性学习中探索葡萄糖分子的组成和结构时设计并完成的一组实验:将下列四种液体分别取2 mL加到2 mL的新制Cu(OH)2悬浊液中,充分振荡。实验现象记录如下表:
| 液体 |
葡萄糖溶液 |
乙醇 |
甘油(丙三醇) |
水 |
| 实验现象 |
氢氧化铜溶解,溶液呈绛蓝色 |
氢氧化铜不溶,混合物蓝色变浅 |
氢氧化铜溶解,溶液呈绛蓝色 |
氢氧化铜不溶,混合物蓝色变浅 |
根据上述实验及现象能够得出的正确结论是( )
A.葡萄糖分子中可能含有醛基
B.葡萄糖分子中可能含有多个羟基
C.葡萄糖的分子式为C6H12O6
D.葡萄糖分子碳链呈锯齿形
被称为“脑黄金”的DHA是从深海鱼油中提取出的不饱和程度很高的脂肪酸,它的分子中有6个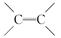 ,称为二十六碳六烯酸,则其甘油酯的结构简式为( )
,称为二十六碳六烯酸,则其甘油酯的结构简式为( )
| A.(C25H51COO)3C3H5 |
| B.(C25H39COO)3C3H5 |
| C.(C26H41COO)3C3H5 |
| D.(C26H47COO)3C3H5 |
某学生设计了如下实验方案用以检验淀粉水解的情况: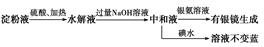
下列结论正确的是( )
| A.淀粉尚有部分未水解 |
| B.淀粉已完全水解 |
| C.淀粉没有水解 |
| D.淀粉已发生水解,但不知是否完全水解 |
苹果汁中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
| A.酸性 | B.碱性 |
| C.氧化性 | D.还原性 |
“小油脂,大道理”。只有少女体内脂肪含量正常,才能正常产生性激素,促进少女的女性第二性征的发育,形成特有的女性美。因害怕发胖而拒食含脂肪食物的做法是不可取的。下列物质属于油脂的是( )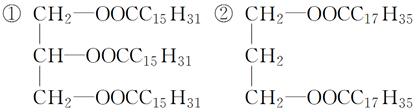
③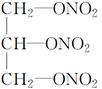 ④润滑油 ⑤花生油 ⑥石蜡
④润滑油 ⑤花生油 ⑥石蜡
| A.①② | B.④⑤ |
| C.①⑤ | D.①③ |