下列图象能正确表示相关反应中产物物质的量的变化的是( )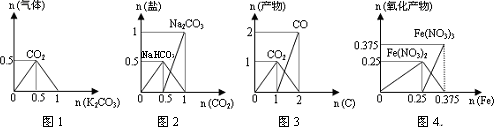
(横、纵坐标单位:mol)
| A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 |
| B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 |
| C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 |
| D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
下列物质的性质比较,正确的是( )
| A.酸性:H2SO4>HClO4>HBrO4 | B.半径:Li+<Mg2+<Al3+<O2- |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>HCl>H2S |
下列有关卤族元素的叙述不正确的是()
| A.卤素单质从F2到I2,颜色加深,熔沸点升高 |
| B.卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 |
| C.卤族元素从F到I, HX水溶液酸性增强 |
| D.卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
下列有关碱金属元素的叙述正确的是()
| A.碱金属单质均为银白色,密度均小于水 |
| B.碱金属单质从Li到Cs,熔点依次升高 |
| C.氢氧化铯碱性强于氢氧化钠 |
| D.碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强 |
国际无机化学命名委员会将元素周期表原有的主、副族符号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法正确的是 ( )
| A.原子最外层有2个电子的元素一定在第2列 |
| B.第2~12列元素全为金属, 第3列元素种类最多 |
| C.第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
| D.115号元素在第13列,为金属元素 |
月球土壤中含有较丰富的3 2He,在地球上氦元素主要以4 2He的形式存在,下列说法正确的是( )
| A.3 2He代表原子核内有2个质子和3个中子的氦原子 |
| B.3 2He和4 2He互为同位素 |
| C.3 2He和4 2He分别含有1和2个质子 |
| D.3 2He的最外层电子数为1,所以3 2He具有较强的金属性 |