某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,
现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
回答下列问题:
⑴混合物中是否存在CuCl2 (填“是”或“否”);
⑵混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
⑶写出反应③中的离子方程式
。
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)。
___________________________________________________________________________。
某温度下0.1mol/L Na2CO3溶液中,[Na+]/[CO32—]=20/9>2,其原因是____________,现向Na2CO3溶液中通入一定量的CO2后,[Na+]/[CO32—]=5/2>20/9,其原因是_________,此时[HCO3—]=_____________。
拆开1mol共价键所需吸收的能量如下表:
| 共价键 |
H-H |
N≡N |
N-H |
| 吸收的能量/kJ |
436 |
946 |
391 |
(1)1mol N2完全反应为NH3(填:吸收或放出)kJ能量
(2)事实上,将1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是。
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大,D、G同主族,A与B、C、D能形成电子数相同的二种常见分子,E、F的原子序数之和是D的原子序数的3倍,D、E、F的简单离子具有相同电子层结构。
(1)三种元素的名称。B,D,F。
(2)A与 D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
D、A与G均可形成18e—的化合物。两种化合物在水溶液中反应的化学方程式为:
(3) A、D、E三种元素中的两种或三种形成的物质中,含有非极性键的离子化合物的电子式为:;只含离子键的化合物的电子式为:。
(4)E离子的半径(填“大于” “小于”或“等于”)F离子的半径;E 和F元素最高价氧化物对应的水化物之间反应的离子方程式为:。
(5)写出由上述各种元素形成的粒子中与BC—电子数相等的三种分子的化学式、。
将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: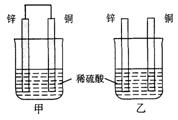
(1)下列说法正确的是____________。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的pH均增大 |
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________。
有A、B、C、D、E、F六种有机物,在一定条件下可发生如右图所示的转化关系。A可作为衡量一个国家石油化工发展水平的标志之一,A可氧化生成D,D与新制的Cu(OH)2悬浊液共热可生成一种砖红色沉淀,A与NaOH溶液共热得到C和无机盐NaX,在经硝酸酸化的NaX溶液中加入硝酸银溶液会产生淡黄色沉淀,燃烧等物质的量的这六种有机物,F燃烧产生的CO2的物质的量是其他有机物的2倍,只有C与E能与钠反应产生气泡。试推断:
⑴各物质的结构简式:A;B;C;D;E;F。
⑵C在浓硫酸作用下加热到170℃可制取A,写出该反应的化学方程式:
___________________________________。
⑶下列反应中属于氧化反应的是(填写序号)。
①D→E②D→C③E→F④C→D⑤F→E