原子序数小于36的A、B、C、D四种元素,A原子基态时最外层电子数是其内层电子数的2倍,B原子基态时2p原子轨道上有3个未成对的电子,C的基态原子中有4个未成对电子,D的原子序数比C大3。
回答下列问题:
(1)B的氢化物沸点比A的氢化物沸点高,其主要原因是 。(2)元素A的一种氧化物与元素B的一种氧化物互为等电子体(原子个数和电子个数均相等的为等电子体),元素B的这种氧化物的分子式是 。
(3)C3+核外电子排布式是
( 6 分)回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H0(填“>”、“<”、“无法确定”)。
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H0(填“>”、“<”、“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +" 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g)△H2= —7.0 kJ/mol
则甲酸的分子式为,在该条件下,气态CO2和气态H2生成气态CO和气态H2 O的热化学方程式为。
O的热化学方程式为。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧 化剂液态双氧水(H2O2)。
化剂液态双氧水(H2O2)。
当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ
的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为
。
(本小题共15分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。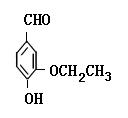
(1)以下推测正确的是( 填字母)。
填字母)。
| A.从分子结构上看,它应该属于芳香烃 |
| B.该物质的一个分子内含有一个碳氧双键、三个碳碳双键 |
| C.1 mol该物质最多能与4molH2发生加成反应 |
| D.该物质能与碳酸钠溶液反应产生CO2气体 |
(2)R物质属于乙基香兰素的同分异构体,其分子中苯环上有2个取代基,R可以发生水解反应生成M和N两种有机物。M可与饱和溴水反应生成白色沉淀。N的质谱图相对分子质量为32,且红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收。
试写出符合条件的R的结构简式(任写两种) ;。
(3)X也是乙基香兰素的同分异构体,可以利用X通过不同的反应制得下列物质。
请回答下列问题:
①X中所含官能团的名称是 反应Ⅰ的反应类型是;
②反应Ⅲ所需的试剂是 ;
;
③反应Ⅳ的化学方程式为
(10分,每空2分)A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。 
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________ (填序号)
(填序号)
a.C b.Al c.S d.Mg
(2)若X是日常生活中最常用的金 属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
反应②的离子方程式为:
C溶液中加入NaOH溶液后产生的现象是
(3)若A在常温下为气态化合物,C是红棕色的气体,C与水反应后所得的浓溶液D与铜反应又生成C气体。则:反应①的化学方程式:;
D的稀溶液与铜反应的离子方程式为:
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: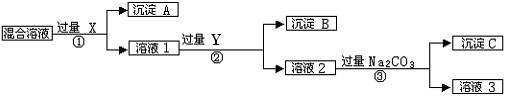
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X :,沉淀A:,试剂Y:,沉淀B:。
(2)上述实验流程中加入过量的Na2CO3的目的是。
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
(4)写出实验流程①②所涉及的离子方程式。
①;② 。
。
(5分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取铁酸钠的化学方程式是(未配平):
Fe(NO3)3 + NaOH + Cl2 → Na2FeO4 + NaNO3 + NaCl + H2O
(1)铁酸钠中,铁元素的化合价是;上述制取铁酸钠的反应中,铁元素被(填“还原”或“氧化”)。
(2)铁酸钠溶解于水,立即与水发生剧烈反应,放出氧气,正是这些在水中新产生出的氧原子发挥其极强的氧化能力给水杀菌消毒的。铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体,使水中悬浮物沉聚, Fe(OH)3胶体微粒直径的范围是__________nm,铁酸钠的电离方程式是 。
。