氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。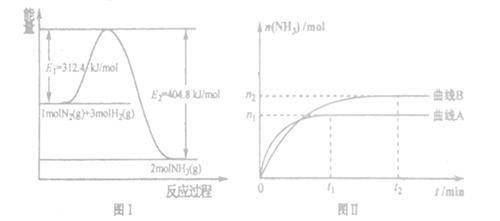
下列说法正确的是_______。
| A.ΔH=-92.4kJ/mol |
| B.使用催化剂会使E1的数值增大 |
| C.为了提高转化率,工业生产中反应的浓度越低越好 |
| D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB |
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为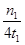 mol/(L·min)
mol/(L·min)
(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的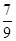 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式_____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1molN2实际提供460kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
重水(D2O)的离子积Kw="1.6×10" -15 mo12·L-2.,可以用pH一样的定义来规定 pD=—lg[D+],试求该温度下:(已知lg5=0.6990;lg3=0.4771;lg2=0.3010;计算时选取合适的数据)
①重水的pD= ;
②含0.01molNaOD的D2O溶液1L,其pD= ;
③溶解0.01molDCl的D2O溶液1L,其pD= ;
④在100mL0.25mol.L-1的DCl重水溶液中,加入50mL0.2 mo1·L-1的NaOD的重水溶液,其pD= ;
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作时该电池的总反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。试根据上述情况判断:
(1)蓄电池的负极材料是______________________。
(2)工作时,正极反应为______________________。
(3)工作时,电解质溶液的酸性________(填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向________极。(填“正”或者“负”)
(5)电流方向从________极流向________极。(填“正”或者“负”)
写出下列电极方程式书写:
(1)酸性电解质的条件下氢氧燃料电池负极的电极方程式 ;正极的电极方程式 ;
(2)氢氧化钾做电解质条件下写出甲醇(CH3OH)的燃料电池的负极的电极方程式 ;正极的电极方程式 ;
(3)写出碱性锌锰原电池的负极的电极方程式 ;正极的电极方程式 ;
(4)写出铅蓄电池放电的负极的电极反应方程式 ;
分析下列溶液蒸干后得到的固体是什么?写出化学式:
(1)Na2CO3溶液蒸干得到的固体物质是 ,
(2)(NH4)2SO4溶液蒸干得到的固体物质是 ,
(3)Ba(HCO3)2溶液蒸干得到的固体物质是 ,
(4)Na2SO3溶液蒸干得到的固体物质是 ,
(5)Mg(HCO3)2溶液蒸干得到的固体物质是 。
(6)Fe2(SO4)3溶液蒸干得到的固体物质是 。
某温度(t℃)时,水的离子积为Kω=5×10-13mol2·L-2,则该温度 25℃,(选填“>”、“<”或“=”)其理由是 。