重水(D2O)的离子积Kw="1.6×10" -15 mo12·L-2.,可以用pH一样的定义来规定 pD=—lg[D+],试求该温度下:(已知lg5=0.6990;lg3=0.4771;lg2=0.3010;计算时选取合适的数据)
①重水的pD= ;
②含0.01molNaOD的D2O溶液1L,其pD= ;
③溶解0.01molDCl的D2O溶液1L,其pD= ;
④在100mL0.25mol.L-1的DCl重水溶液中,加入50mL0.2 mo1·L-1的NaOD的重水溶液,其pD= ;
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。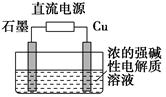
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。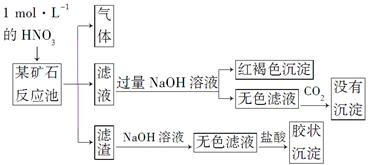
(1)Si在周期表中的位置是___________________________________。
(2)下列说法正确的是________。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是________,滤渣和NaOH溶液反应的离子方程式是_________________________________________________________。
(4)该矿石和1 mol·L-1HNO3反应的离子方程式为
___________________________________________________________。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中。目的是____________________________________;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol·L-1 HNO3的体积为________L。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: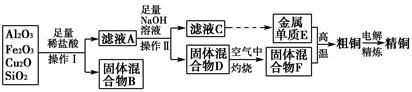
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中的悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图如下。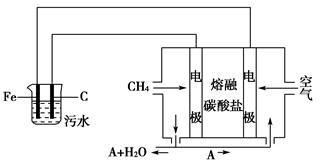
请回答下列问题。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.BaSO4 c.Na2SO4
d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是:①__________;②4OH--4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是________________。
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4+4CO32—-8e-=5CO2+2H2O。
①正极的电极反应是____________________________________________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见装置示意图)。A物质的化学式是____________________________________________________________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________________________________________________L。
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。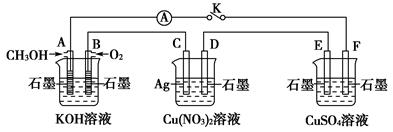
甲池 乙池 丙池
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是________(填“甲池”“乙池”或“丙池”)。
(2)丙池中F电极为________(填“正极”“负极”“阴极”或“阳极”),该池的总反应式为__________________________________________________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是________(填选项字母)。
| A.Cu | B.CuO | C.CuCO3 | D.Cu2(OH)2CO3 |