煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
试回答下列问题:
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E);
| |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
2 |
1 |
2 |
3 |
| D |
0.5 |
2 |
1 |
1 |
| E |
3 |
1 |
2 |
1 |
(2)在1L密闭容器中通入10 molCO和10 mol水蒸气,在500℃下经过30s达到平衡,则30s内CO的平均反应速率为
(3)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g)
2CO(g)平衡常数K;K的表达式 ;C(s)+H2O(g) CO(g)+ H2(g)平衡常数K1; CO(g)+H2O(g)
CO(g)+ H2(g)平衡常数K1; CO(g)+H2O(g) H2(g)+ CO2(g)平衡常数K2;则K、K1、K2之间的关系是:
H2(g)+ CO2(g)平衡常数K2;则K、K1、K2之间的关系是:
(4)某温度、容积固定容器中,投入一定反应物,对可逆反应C(s)+ CO2(g) 2CO(g)不能判断该反应达到化学平衡状态的是
2CO(g)不能判断该反应达到化学平衡状态的是
A.c(CO2)= c(CO)
B.混合气体相对分子质量不变
C.容器中的压强不变
D.v正(CO)= 2v正(CO2)
E.c(CO)保持不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)  2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.
2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.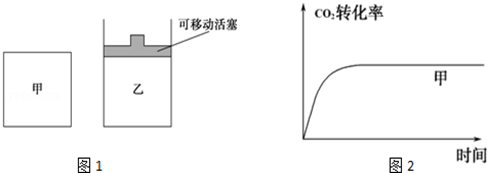
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________________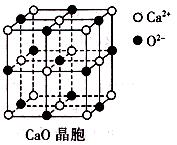
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子 ,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色” 消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备C1O2的流程如下:
(1)C1O2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________
A.饱和食盐水B.碱石灰 C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________(填选项字母)。
A.二氧化氯可广泛用于工业和饮用水处理
B.二氧化氯应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和检测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学方程式为________。此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式为________此法相比欧洲方法的优点是________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学方程式为________。此法提高了生产及储存、运输的安全性,原因是_________
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
| 阳离子 |
Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 |
SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______ (填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______ (填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为____________________
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为。
N、O、S三种元素的电负性由大到小的顺序为。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y 与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图所示的离子: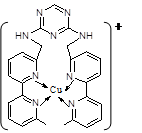
①写出Cu(Ⅰ)的电子排布式;
②该离子中含有化学键的类型有(选填序号);
| A.极性键 | B.离子键 | C.非极性键 | D.配位键 |
③该离子中C原子的杂化方式有。
(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图所示。写出该反应的离子方程式。
氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为。
(2)反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。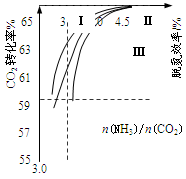
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为(选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=(空气中氧气的体积含量大约为20%)。
②下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为%。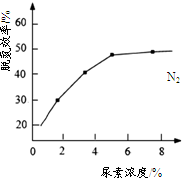
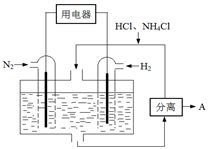
(4)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式。生产中可分离出的物质A的化学式为。