单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu2O、Cu。现将2.00g C与16.0g CuO的混合物,隔绝空气加热一段时间后,将生成的气体通过足量的澄淸石灰水,共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物中Cu的质量为12.8 g |
| C.反应后的固体混合物总质貴为14.4 g |
| D.反应后的固体混合物中氧化物的物质的量为0.05mol |
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
| A.达到平衡时X浓度为0.04mol/L |
| B.将容器体积变为20 L,Z的平衡浓度变为0.015 mol/L |
C.若升高温度,X的体积分数增大,则该反应的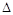 H<0 H<0 |
| D.若增大压强,平衡向正反应方向移动,平衡常数变大 |
已知:①H2O(g)===H2O(l) ΔH=-Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1
下列判断正确是
| A.酒精的燃烧热ΔH=-Q3 kJ·mol-1 |
| B.由③可知1 mol C2H5OH(g)的能量高于2 mol CO2(g)和3 mol H2O(g)的总能量 |
| C.H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 |
| D.23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
在一定温度下,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡的标志是
2NH3(g)达到平衡的标志是
| A.NH3的生成速率与NH3的分解速率相等 |
| B.单位时间内生成nmolN2的同时生成3nmolH2 |
| C.N2、H2、NH3的浓度不再发生变化 |
| D.N2、H2、NH3的物质的量之比为1:3:2 |
用铂(惰性)电极进行电解,下列说法中正确的是
| A.电解氯化钠溶液,在阴极析出钠 |
| B.电解熔融氯化镁制取镁时,阴极和阳极生成的产物物质的量之比为1:1 |
| C.电解稀硫酸,在阴极和阳极分别产生氧气和氢气 |
| D.电解熔融氧化铝过程中,若有3.01×1024个电子转移,则生成1mol铝 |
根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g)  2HI(g) △H = -9.48 kJ·mol-1
2HI(g) △H = -9.48 kJ·mol-1
(2) I2(s)+ H2(g)  2HI(g) △H =" +26.48" kJ·mol-1
2HI(g) △H =" +26.48" kJ·mol-1
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |