工业生产纯械的工艺流程示意图如下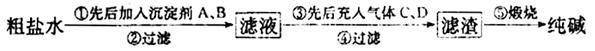
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式_________。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是_________(填化学式),原因是_________。
(3)通入C和D气体后发生反应的化学方程式是_________。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品________ (填写化学式),通氨气与加入细小食盐颗粒的作用是_________。
(5)写出⑤锻烧发生反应的化学方程式_________。产品纯碱中含有碳酸氢钠,若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质童分数ω(NaHCO3)= _________ (注明表达式中所用的有关符号的含义)。
有一白色固体X,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙中的一种或几种。为探究其组成进行如下实验,主要流程及现象记录如下:
【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性
回答下列问题:
(1)根据步骤①实验现象确定白色固体X中一定没有的物质是____________。
(2)步骤②中发生反应的化学方程式是____________________________________。
(3)步骤③中产生白色沉淀A的化学方程式是________________________________。
(4)白色固体X中的物质有____________。
(5)将白色固体X转化成氯化钠固体的实验方案是____________________。
某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示,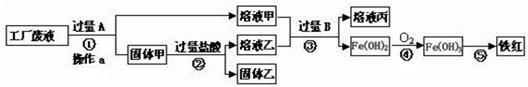
回答下列问题。
(1)固体甲_______,操作a的名称是_______。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)溶液甲中的金属离子是 (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。
某化学兴趣小组的同学利用如图所示的装置验证Na2CO3样品的纯度(样品中的杂质与稀盐酸不反应),小资料:无水CaCl2可作干燥剂,与CO2不反应。
(1)有关反应的化学方程式为______。
(2)装置中的“无水CaCl2”的作用是______。
(3)若反应前,称量整个装置及药品的总质量为598.6g,其中样品质量为6g;打开分液漏斗向广口瓶中加入足量的稀盐酸,充分反应后,应该进行的操作是______,然后再第二次称量整个装置及药品的总质量为596.4g,则该样品的纯度为(样品中碳酸钠的质量分数)为_________。
A~F为初中化学常见物质,它们由H、C、O、Cl、Na、Ca中的元素组成。
(1)A为氧化物,可用于制备改良酸性土壤的碱,写出用A制备碱的化学方程式 。
(2)B、C均为液体,且组成元素相同,C在一定条件下可生成B,B的化学式为 。
(3)D用于玻璃、造纸、纺织、洗涤剂的生产。
取D溶液进行实验,操作及部分现象如图所示。D与F反应的化学方程式为 。
(4)从上述物质中任选2种为一组,按下图装置进行实验,将液体滴入瓶中,关闭活塞。请根据表中现象,写出符合要求的物质。
| 现象 物质 |
气球变鼓,一段时间后恢复原状 |
气球变鼓,一段时间后不恢复原状 |
| 液体 |
||
| 固体 |
某研究性学习小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。查阅资料:CO2 + Zn  CO + ZnO;FeCl3溶液遇KSCN溶液变红。
CO + ZnO;FeCl3溶液遇KSCN溶液变红。
请回答下列问题:
(1)仪器A的名称是 ,装置B的作用是 ,尾气处理的方法是 。
(2)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D进行加热,其产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入盐酸 |
溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) |
溶解,有气泡,溶液呈浅绿色 |
| 2 |
取步骤1所得溶液,滴加KSCN溶液 |
变红 |
无现象 |
则甲组步骤1中反应的化学方程式是 ,乙组得到的黑色粉末是 。
(3)从安全考虑,本实验应在装置 和 之间添加装置E防止倒吸。(填字母编号)
(4)该对比实验结果表明CO的还原能力随温度的升高而 (填“增强”或“减弱”)。