某研究性学习小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。查阅资料:CO2 + Zn  CO + ZnO;FeCl3溶液遇KSCN溶液变红。
CO + ZnO;FeCl3溶液遇KSCN溶液变红。

请回答下列问题:
(1)仪器A的名称是 ,装置B的作用是 ,尾气处理的方法是 。
(2)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D进行加热,其产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入盐酸 |
溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) |
溶解,有气泡,溶液呈浅绿色 |
| 2 |
取步骤1所得溶液,滴加KSCN溶液 |
变红 |
无现象 |
则甲组步骤1中反应的化学方程式是 ,乙组得到的黑色粉末是 。
(3)从安全考虑,本实验应在装置 和 之间添加装置E防止倒吸。(填字母编号)
(4)该对比实验结果表明CO的还原能力随温度的升高而 (填“增强”或“减弱”)。
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为: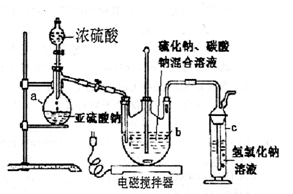
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因:。
(3)步骤③中不能将溶液蒸发至干的原因是;晶膜通常在溶液表面出现的原因是。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是____,间接碘量法滴定过程中可能造成实验结果偏低的是____。
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
阿司匹林(乙酰水杨酸,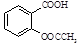 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是。
(2)写出制备阿司匹林的化学方程式。
(3)反应过程中,要控制温度在85 ℃~90 ℃,其原因是,
应采用的加热方法是。用这种方法加热需要的玻璃仪器有。
(4)抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是。
(5)如何检验产品中是否混有水杨酸?。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的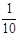 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______。
(2)装置a和c的作用分别是____和____(填标号)。
A除去SO2气体 B除去空气中的水蒸气 C有利于气体混合
D有利于观察空气流速 E除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。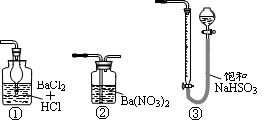
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
某兴趣小组的同学发现,将CuSO4溶液与Na2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
Ⅰ.【提出猜想】
猜想1:所得沉淀为;
猜想2:所得沉淀为;
猜想3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2·nCuCO3]。
Ⅱ.【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
Ⅲ.【实验探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:取一定量所得固体,用如下装置(夹持仪器未画)进行定性实验;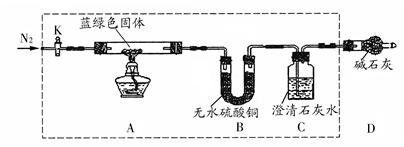
Ⅳ.【问题讨论】
能证明猜想1成立的实验现象是;
(1)检查上述虚线框内装置气密性的实验操作是:关闭K,;
(2)若在上述装置B中盛放无水CaCl2,C中盛放Ba(OH)2溶液,还可以测定所得沉淀的组成。
①C中盛放Ba(OH)2溶液,而不使用澄清石灰水的原因是;
②若所取蓝绿色固体质量为27.1 g,实验结束后,装置B的质量增加2.7 g,C中产生沉淀的质量为19.7 g 。则该蓝绿色固体的化学式为。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。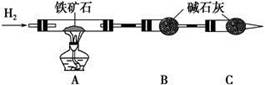
(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。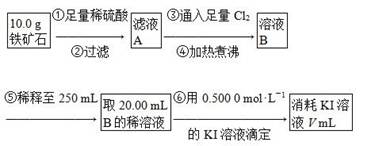
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。