化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有______
_________________________________________________________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有________。
现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。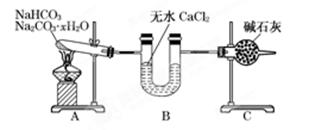
(1)A装置的作用:________________________________________________________________。
(2)B装置的作用是:_______________________________________________________________。
(3)C装置的作用是:_________________________________________________________________。
(4)若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89g,C管增重0.22 g,则x的值为______。
(5)该装置还不是很完善,可能使测定结果偏小,应如何改进________。为什么?___________________________________________________________________________________。
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。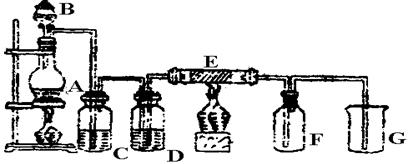
试回答:
(1)A中发生的化学反应的离子方程式为。
(2)C、G中各装的药品:C__________;G__________。
(3)E反应方程式为。
(4)写出G中反应的离子方程式。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。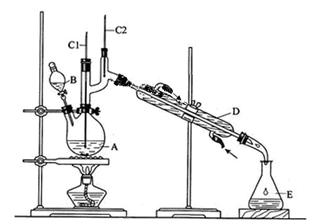
发生的反应如下:
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/g·cm-3 |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)加入沸石的作用是,若加热后发现未加入沸石,应采取的正确方法是。
(3)上述装置图中,B仪器的名称是,D仪器的名称是。
(4)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是。
(6)本实验中,正丁醛的产率为%。
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O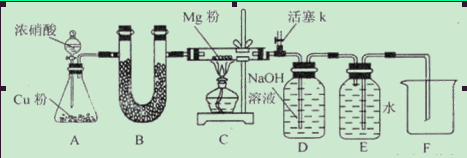
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸②无水CaCl2③碱石灰④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。