下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。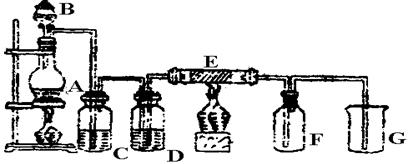
试回答:
(1)A中发生的化学反应的离子方程式为 。
(2)C、G中各装的药品:C__________;G__________。
(3)E反应方程式为 。
(4)写出G中反应的离子方程式 。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因 。
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了下图所示装置和实验方案。实验步骤如下: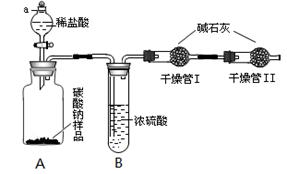
①按图将仪器组装好并检查气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1);
③准确称量纯碱样品的质量(设为n),放入广口瓶A内;
④打开分液漏斗a的旋塞,缓缓滴入稀盐酸,至不再产生气泡为止;
⑤称量干燥管Ⅰ的质量(设为m2)。
(1)实验操作④要缓缓地进行,其理由是_________。如果操作太快,会导致测定结果________(填偏大、偏小或不变)。
(2)装置B的作用是_____________________;干燥管Ⅱ的作用是___________________。
(3)根据甲同学的实验数据,写出计算纯碱样品纯度的公式_______________________。
(4)方案评价:乙同学认为甲同学的方案有缺陷。乙同学认为稀盐酸要改为稀硫酸,否则会导致测定结果偏大。你认为还有其它缺陷吗?如果有,提出你的改进意见或需要添加的实验步骤,并指出甲同学缺少这一步骤会对结果产生什么影响(填偏大、偏小或不变),将答案填入表中(不一定要填满)。
| 序号 |
改进意见 |
缺少时的影响 |
| ① |
||
| ② |
||
| ③ |
右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol/L的稀硫酸。
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的 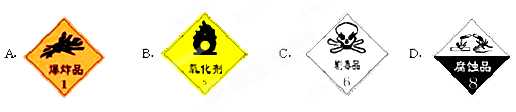
(2)配制稀硫酸时,还缺少的仪器有 (写仪器名称);
(3)经计算,配制480 mL 1 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL,量取硫酸时应选用mL规格的量筒;
A.10 mL B.50 mL C.100 mL D.200mL
(4)在烧杯中稀释浓硫酸的实验操作为,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为 。
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol/L,配制过程中下列各项操作可能引起该误差的原因有 ( )
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_______________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是__________________________。
实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.2mol/L的盐酸溶液
| 计算应称量盐酸体积/mL |
应选用容量瓶的规格/mL |
除量筒、容量瓶、烧杯外还需的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是____,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作;
若加蒸馏水时不慎超过了刻度;
若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)溴与氯能以共价键结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为。
(3)操作Ⅱ的名称是。操作Ⅲ一般适用于分离____________混合物。(选填编号)
| A.固体和液体 | B.固体和固体 | C.互不相溶的液体 | D.互溶的液体 |
(4)混合②中加入Na2SO3的目的是。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为. 乙同学取制得的氢溴酸少许,向其中加入CCl4,有机物层变为橙色,则证明在该溶液中含有_________。