实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.2mol/L的盐酸溶液,填空并请回答下列问题:
(1) 配制250mL0.2mol/L的盐酸溶液
| 计算应称量盐酸体积/mL |
应选用容量瓶的规格/mL |
除量筒、容量瓶、烧杯外还需的其它仪器 |
| |
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) _ __ __;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ____ ,
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作 ;
若加蒸馏水时不慎超过了刻度 ;
若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面__________________________________________________________________________ 。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。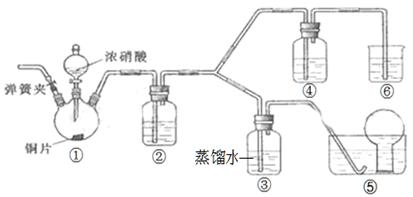
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及CO2。
已知氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O。
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是、
、。
(2)滴加浓硝酸之前,需打开弹簧夹,通入一段时间的CO2,其目的是
。
(3)装置①中发生反应的离子方程式是。
(4)装置②的作用是,发生反应的化学方程式是。
(5)该小组得出的结论依据的实验现象是。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是。(可多选)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氧气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
某化学兴趣小组为探究SO2的性质,查阅相关资料知:实验室制取SO2气体的反应原理为Na2SO3 + H2SO4  Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。
Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。
|
指出下面3个实验中各存在的一个错误:
A___________________ B_____________________ C__________________
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、、摇匀。
②“步骤一”所得溶液的颜色为。
③写出“步骤二”中加锌粉产生气泡的离子方程式;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式。
④“步骤三”KMnO4溶液应装在式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是 ;
判断滴定至终点依据的现象是 。
⑤实验测得该晶体中铁的质量分数为。
某研究小组探究SO2和Fe(NO3)3溶液的反应。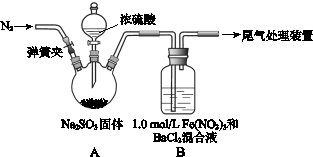
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是。
(3)装置B中产生了白色沉淀,其成分是,说明SO2具有性。
(4)分析B中产生白色沉淀的原因:
观点1:_____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液