某研究小组探究SO2和Fe(NO3)3溶液的反应。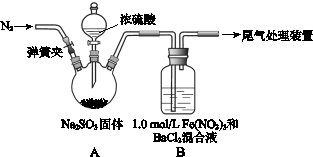
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生白色沉淀的原因:
观点1: _____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是 。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号) 。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究。
方案Ⅰ:在盛有少量无水乙醇的试管中,加入一粒除去煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上,在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊产生。
(1)请写出乙醇与钠反应的化学方程式: ▲。
(2)以上实验设计因缺少必要的步骤而存在安全隐患,请你指出所缺少必要的步骤是
▲。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,则燃烧产生CO2的物质最可能是
▲ (写名称)。
方案Ⅱ:(1)取一根铜丝,把其中一端绕成螺旋状(增大接触面积)。点燃一盏酒精灯,把绕成螺旋状一端的铜丝移到酒精灯外焰上灼烧(如右图1),观察到的实验现象: ▲。
(2)把螺旋状铜丝往酒精灯内焰移动,观察到的实验现象: ▲,用化学方程式表示该现象产生的原理: ▲。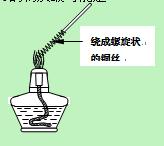
镁能在二氧化碳中燃烧:2Mg+CO22MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。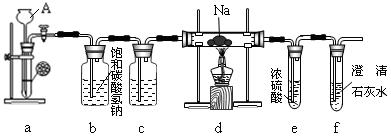
请回答下列问题:
(1)装置a的作用是,仪器A的名称。
(2)装置b的作用是,装置c中应盛放。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热有刺激性气味的气体生成。则该黑色物质与浓硫酸共热的化学反应方程式为。
(5)往(4)所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。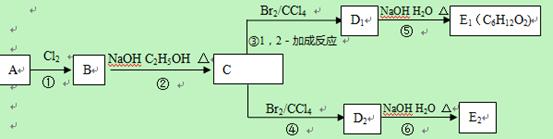
反应②的化学方程式为
;
C的化学名称为;
E2的结构简式是;
④、⑥的反应类型依次是
 、。
、。
A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B和甲醇。B中碳、氢、氧原子个数比为1:1:1,分子中没有支链,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填编号)
① 加成反应② 酯化反应③ 加聚反应④ 氧化反应
(2)B分子所含官能团的名称是。
(3)与B具有相同官能团的同分异构体的结构简式是 _______________。
(4)由B制取A的化学方程式是:
。
为了粗略测定电石中碳化钙的质量分数,某研究性学习小组设计了如下图所示的制气与除杂装置。请参与研究并回答相关问题: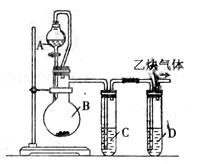
(1)写出烧瓶B中发生反应的 化学方程式:___
化学方程式:___ ___________________________。
___________________________。
(2)漏斗与烧瓶之间用玻璃导管连接,其目的是________________________________________________________。
(3)试管中装有同一种蓝色溶液,该溶液是____________,其中试管C的作用是_______________________,试管D的作用是____________ ____________。
____________。
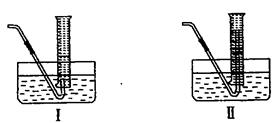
(4) 为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______
为了测量产生的乙炔气体的体积,该小组同学设计了下图所示的两种装置。则应选择装置_______ __(填Ⅰ或Ⅱ)。
__(填Ⅰ或Ⅱ)。